Continua con questa seconda parte il pezzo sulla mirra, che inizia qui.
Mirra oggi: definizione e descrizione
Ci sono 190 specie di Commiphora (famiglia delle Burseraceae) distribuite in Africa, India, Penisola Arabica usate tradizionalmente come incenso e medicina. La mirra (Gummi Myrrha) è la gommo-oleoresina essiccata all’aria ottenuta dai fusti e dai rami di Commiphora myrrha (Nees) Engl. (sinonimi Balsamea myrrha (T.Nees) Oken;B. myrrha Baill.; B. playfairii Engl.; Balsamodendrum myrrha T.Nees; Commiphora coriacea Engl.; C. cuspidata Chiov.; C. molmol (Engl.) Engl. ex Tschirch[82].
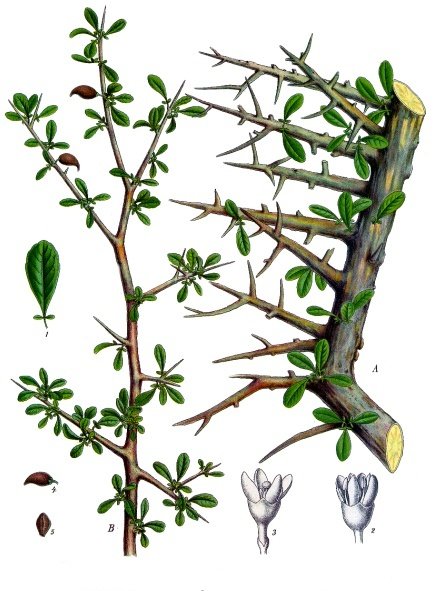
Questa specie è un albero indigeno dell’Africa Nordest (Gibuti; Etiopia; Somalia e Kenya), in particolare di Somalia ed Etiopia (e in misura minore Sudan)(CHP) e dell’Arabia meridionale (Oman; Yemen). La droga, a volte di qualità inferiore, si ricava però anche da altre specie: Commiphora habessinica (O.Berg) Engl.; (sinonimoC. abyssinica); Commiphora schimperi (O.Bergman) Engl.; altre inferiori C. foliacea Sprague, Commiphora playfairii (Hook.f.) Engl C serrulata Engl.. Commiphora africana (A.Rich.) Endl in Etiopia e Sudan.
La pianta cresce fino a 3 metri di altezza o più anche se si conoscono forme nane, e porta foglie dentate verdi. Fessure e spaccature si formano naturalmente nella corteccia dalle quali la resina essuda naturalmente dai dotti circolari del parenchima, ma la resa aumenta con le incisioni.
Nomi popolari: Myrrh, Myrrha, Myrrhe, African Myrrh, herabol Myrrh, Somali Myrrh, Smyrna, Mur, Murry, Bola o Bol, Vola, Murr, Mirra. olio di Mirra, Stacte.
Raccolta: la resina di mirra, come quella dell’incenso, viene raccolta incidendo la corteccia e lasciando che la resina fuoriesca, si raccolga e si indurisca, in due o tre settimane. A questo punto può essere staccata e raccolta. Questo metodo, ancora in uso oggi, è stato descritto per la prima volta da Teofrasto e più tardi da Erodoto.
Le masse raccolte sono rosso-marroni, vengono ammassate in sacche fatte di pelle di capra e mandate quasi esclusivamente ad Aden. La qualità di Mirra più ricercata è la “ogo”, proveniente dalle aree interne lontane dalla costa somala e da Guban[83]. Tempo addietro le masse resinose (gocce o lacrime di mirra) venivano esportate da Aden in paesi stranieri dove venivano lavorate per produrre resinoidi ed olii.
La Somalia è il più grande esportatore al mondo di Mirra, Opopanax (Commiphora kataf (Forssk.) Engl., [= C. erythraea (Ehrenb.) Engl.], Olibanum (Boswellia sacraFlueck. [=B. carteri Birdw.]) e Maidi (B. frereana Birdw.). Le specie di Commiphoraso trovano nelle località interne secche dal nord all’estremo sud, ma buona parte del materiale esportato dalla Somalia viene in realtà raccolto in Etiopia. Alla fine degli anni 80 il volume di resine di Commiphora esportato ammontava a 1000 tonnellate[84]
La gommo-resina
La sesta edizione della Farmacopea Italiana[85] distingue tra mirra eletta emirra in sorte. La prima “si presenta in grani (lagrime) od in pezzi irregolari di varia grossezza, di colore rossastro o rosso-bruno, screpolati, un po’ efflorescenti, alquanto traslucidi, fragili, di frattura lievemente granellare e lucida, con alcune vene o piccole macchie biancastre o giallicce, talore semilunari. Sapore amarognolo, odore aromatico.
La mirra in sorte è formata di masse conglomerate, brune, opache, miste a frammenti di corteccia ed a varie impurità.”
Le Monografie dell’OMS sulle piante medicinali[86] così la descrivono: “Gummi Myrrha consiste nelle oleo-gommo-resine essiccate all’aria essudate da fusti e rami della Commiphora molmol Engler (Burseraceae) ed altre specie di Commiphora correlate, incluse C. abyssinica Engl., C. erythraea e C. schimperi Engl., ma escludendo C. mukul.” La gommo-resina si presenta come: “gocce o grumi di gocce irregolari o arrotondate di varie dimensioni, di colore da giallo-marroncino a rosso-marrone fino a quasi nero. La superficie è quasi completamente coperta di polvere grigiastra o giallognola; la superficie interna è giallastra o rosso-marrone, che a volte presenta macchie o linee bianche; la frattura è cerosa, granulare, concoidale (a superficie curva) e dà frammenti sottili e traslucenti”.
L’odore è caratteristico, caldo-balsamico, dolce e con toni speziati, aromatico e pungente quando la resina è fresca; il sapore è aromatico, amaro, aspro[87].
La gommo-resina si scioglie parzialmente in acqua, alcol ed etere.
La resina viene usata come nota di base speziata con carattere orientale, come base legnosa, di foresta, di aghi di pino. Si associa bene a geranio, muschio, patchouli, spezie e basi floreali pesanti[88].
Prodotti derivati[89]
La distillazione in corrente di vapore della gommoresina produce il classico olio di mirra, con rese da 1,5% a 15%, ma grazie a recenti tecnologie (come ad esempio distillazione controcorrente “short-path” o “gas-swept” si producono nuove qualità con rese molto elevate.
Olio di Mirra: liquido vischioso giallo con odore caratteristico della gommoresina, cioè resinoso e dolce balsamico, ma con anche un aspetto amaro/astringente. Odore molto persistente. Nota finale debole, secca, legnosa tipo vetivert.
Resinoide di Mirra: ottenuto per estrazione della gommoresina con solventi volatili (nel passato toluene ed esano); è un solido rosso-marrone con odore dolce, balsamico, di zucchero integrale, e uno sfondo oleoso, legnoso e terpenico. La nota finale è dolce, in qualche modo caramellosa, terpenica e di muffa.
Tintura di Mirra: preparata per macerazione della mirra in polvere con alcol etilico a 80°. Appare un liquido di colore rossastro non molto intenso. Odore e sapore di mirra, reazione acida al tornasole; diluita con acqua si intorbida[90].
Composizione chimica
Come per le specie appartenenti al genere Boswellia, anche nelle specie diCommiphora l’essudato contiene polisaccaridi ed è quindi classificato come gommoresina. Una volta indurita è scura e amara al contrario della gommoresina diBoswellia che è pallida e dolce.
La gommoresina è frazionabile in tre parti, due liposolubili ed una idrosolubile:
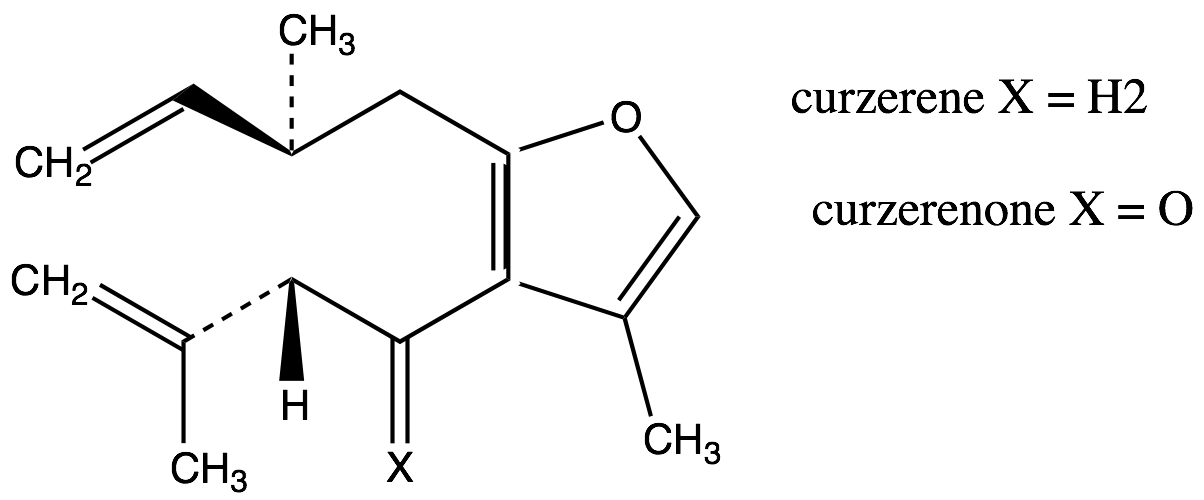
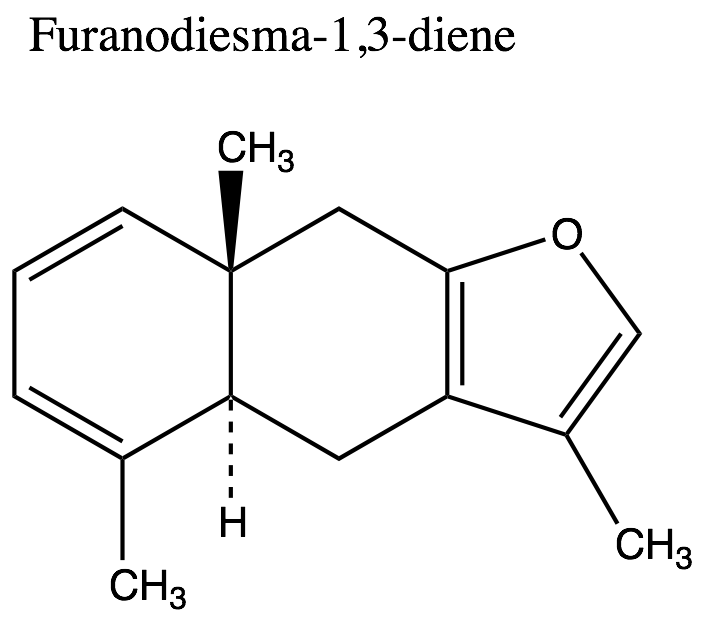
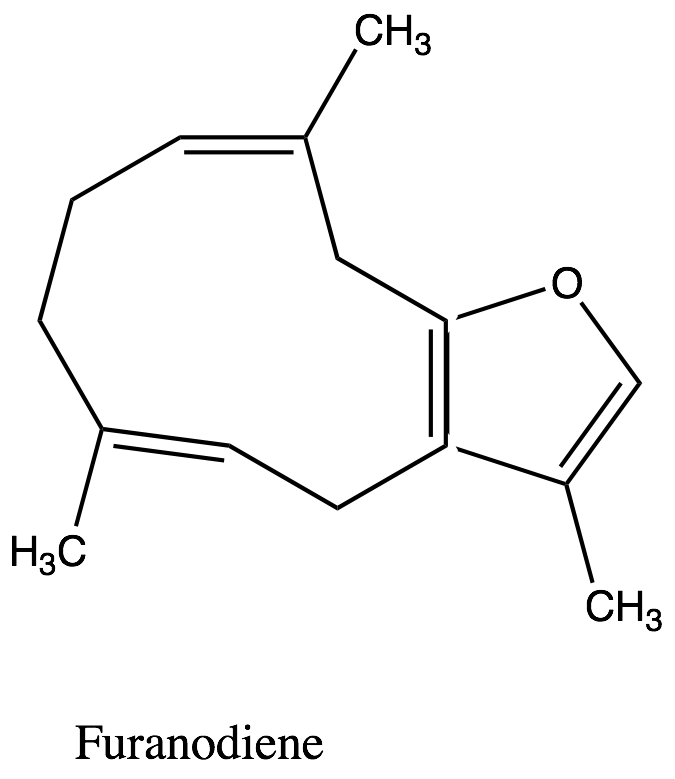
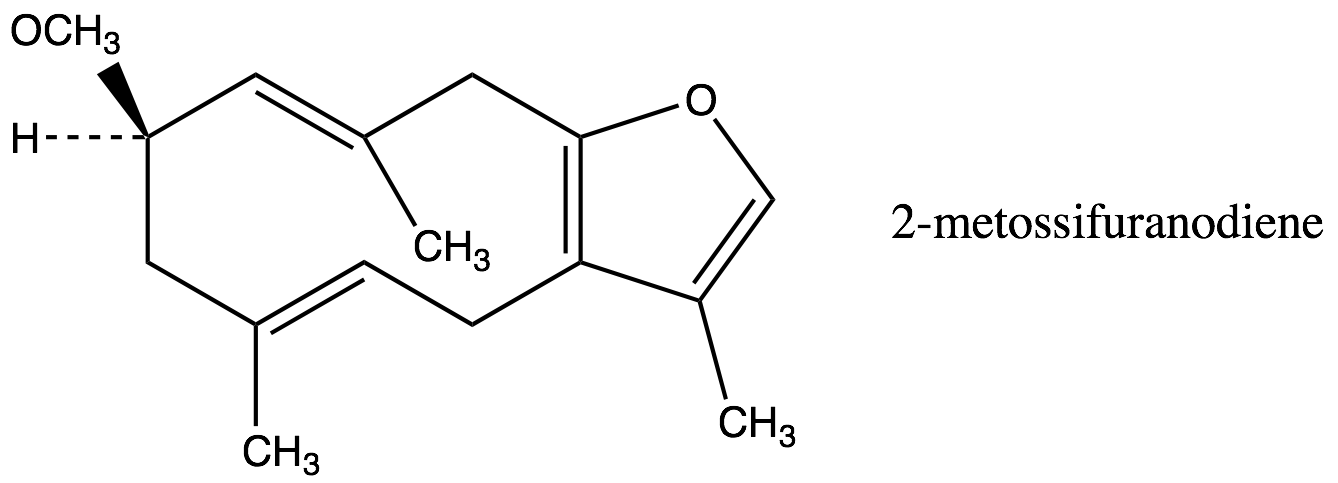
1. Frazione volatile liposolubile, o olio essenziale (1,5-17% – forbice più comune 3-8%): caratterizata sia dai monoterpeni sia dai sesquiterpeni. Tra i monoteropeni troviamo α-, β- e γ−bisabolene, α-pinene, dipentene e limonene, mentre tra i sesquiterpeni troviamo heerabolene, cadinene, curzerene (11.9%), curzerenone(11.7%), diidripirocurzerenone (1,1%), elemolo, beta-elemene, T-cadinolo, commiferinae vari furanosesquiterpenoidi tra i quali il furanoeudesma-1,3-diene (12.5-34.9%), il furanodien-6-one (0.4% ), il furanoeudesma-1,4-diene-6-one, l’isofuranogermacrene, il 1,10(15)-furanodien-6-one, il 2-metossi furanodiene, illindestrene (3.5-12.9%), ecc. Sono presenti anche composti fenolici (cinnamaldeide, cuminaldeide, eugenolo, alcol cuminico, m-cresolo), e germacrone[91] (5.8%). Secondo Burfield[92] i sesquiterpeni, ed in particolare i derivati furanoidi[93], sono icomposti più importanti per l’aroma caratteristico della mirra: furanoeudesma-1,3-diene, lindestrene, curzerenone, curzerene, cadinene, diidropirocurzerenone. Il germacrone impartirebbe l’odore caratteristico, con note erbacee.
2. Frazione non volatile liposolubile o resina (20%, massimo 40%): acidi alfa-, beta- e gamma-commiforico, acido commiforinico, eeraboresene, alfa- e beta-eerabomirroli e commiferina, campesterolo, beta-sitosterolo, alfa-amirone, 3-epi-alfa-amirina.
3. Frazione non volatile idrosolubile o gomma (30–60%): composti che una volta idrolizzati danno D-galattosio, 4-O-metilglucoronato, L-arabinosio in rapporto 8:7:2[94]. Presente anche dello xilosio.
Utilizzi
Bruciata fin dall’antichità come incenso in Arabia, Somalia ed Etiopia[96]. Morton (1977) riporta che il fumo della resina bruciata veniva usato in caso di febbri e per altri disturbi[97].
Una delle droghe vegetali più antiche e apprezzate, la mirra viene ancora usata a livello popolare, per esempio in Marocco come balsamo per disturbi nervosi e applicata durante le cerimonie di pulizia come fumigazione[98]. Viene usata in Egitto come masticatorio in caso di tosse[99]. Nel mondo arabo si usa come antinfiammatorio, antipiretico, antisettico, e stimolante, ed è un rimedio per gastropatie, indigestione, tosse, asma, bronchite, dolore artritico, lebbra e sifilide.
Mrs Grieve[100] la considera un astringente, vulnerario, tonico e stimolante. Lo consiglia come emmenagogo e come tonico in caso di dispepsia, come espettorante in mancanza di segni di febbre, uno stimolante delle mucose, come carminativo stomachico che eccita l’appetito e il flusso di succhi gastrici e come lavaggio astringente.
Tra gli utilizzi che cita troviamo catarro cronico, tisi, clorosi, amenorrea (con Aloe), gengivite, faringite, afta, ulcere indolenti. Esternamente può essere usata per il suo effetto rubefacente.
Secondo Felter[101], la mirra è la miglior applicazione locale per gengiviti, faringiti con afte e ulcere indolenti, faringite cronica con membrane pallide e umide, tonsillite. Internamente, secondo l’autore, la mirra è uno stimolante delle mucose e non dovrebbe essere usata in condizioni infiammatorie. Piccole dosi promuoverebbero la digestione e sarebbero antisettiche, ma dosi più elevate aumentano il ritmo cardiaco e la temperatura e sono irritanti per le mucose gastriche. E’ comunque un rimedio per soggetti debilitati e condizioni croniche e atoniche, soprattutto per quanto riguarda i polmoni.
Secondo la MTC è una pianta amara e neutrale, che rafforza il sangue e riduce il dolore, riduce il gonfiore e promuove la guarigione delle ferite. E’ una pianta con azioni e indicazioni del tutto simili alla Boswellia (incenso) ed insieme ad essa viene usata per trattare i dolori derivanti da traumi e gonfiori[102]: 1. dolore causato da stagnazione del sangue (dismenorrea; mal di stomaco; dolori articolari da vento-freddo-umido; traumi; dolore da foruncoli e eruzioni); 2. foruncoli e ulcere (esternamente).
Al giorno d’oggi viene occasionalmente utilizzata internamente come carminativo, per problemi di stomaco e come espettorante, ma è usata soprattutto come astringente ed antisettico locale per disordini delle mucose orofaringee e della pelle.
Gli Arabi spalmano la resina su una tela nera che, dopo essersi indurita, viene usata per assicurare le fratture. Gli Indiani dissolvono la mirra in latte di asino o di donna e ne fanno uso come collirio; la somministrano alla donna che allatta per aumentare il flusso di latte; la mescolano con borace in caso di stomatite parassitica; mescolano la tintura di mirra con glicerina in caso di difteria; e la consigliano in forma di tintura in caso di clorosi e dismenorrea in giovani donne. In Dhofar la resina dispersa in acqua viene bevuta o spalmata sul corpo in caso di febbre. In Libano la mirra viene usata come carminativo, fumigatorio, vulnerario, gastrite e influenza. Il fumo viene diretto sulle ferite per favorire la guarigione. In Oman la mirra calda viene applicata alle carie in caso di mal di denti. In Arabia saudita la resina viene applicata al seno delle madri che allattano per svezzare i bambini. In Yemen la resina viene spalmata su morsi di serpente e ferite per guarirle, e sul pene come afrodisiaco[95].
Moore[103] la considera una pianta stimolante per tutti i sistemi. E particolarmente per il fegato, il sistema respiratorio, cardiovascolare, linfatico, riproduttivo e per le mucose. Ha una azione tonica sul sistema nervoso centrale e sul parasimpatico.
I prodotti a base di Mirra sono spesso stati usati a livello topico per problemi di igiene orale, una soluzione ottenuta mescolando e scuotendo fortemente la gommoresina in acqua viene usata per disinfettare le gengive, per le infiammazioni della mucosa orale e faringea e per le afte orali. L’olio di mirra è stato usato nei dentifrici. Altre applicazioni sono labbra secche, emorroidi, ferite ed abrasioni, foruncolosi, alitosi.
Resinoidi ed assolute di Mirra sono usate principalmente in fragranze orientali per impartire una nota balsamica, dolce e resinosa. Il resinoide viene usato anche in fragranze da incenso e basi di ambra dolce. Alcuni autori dichiarano che l’odore della mirra somiglierebbe a quello della traspirazione umana, ma altri autori non ritrovano un carattere fortemente animalico o sessuale.
Farmacologia
Dati sperimentali: la resina è antiossidante (scavenger dei radicali liberi), tireotropica, inibitrice delle prostaglandine, e protegge da vari agenti necrotizzanti, citotossici in topi.
Nella sperimentazione animale la resina, l’olio essenziale e i triterpeni hanno mostrato effetti antimicrobici[104]; l’estratto grezzo della gommoresina mostra attività in vitro di potenziamento dell’attività della ciprofloxacina e della tetraciclina contro S. aureus (anche resistente ai farmaci), molte varietà diSalmonella enterica e di Typhimurium e due ceppi di K. pneumoniae[105].
Altre attività provate in vitro o in vivo su modelli animali sono quelle deodorant[106]e, anti-infiammatori[107]a, antitumor[108]ale, astringente, antipiretic[109]a, ipoglicemizzant[110]e, e protettiva dalle ulcer[111]e gastriche.
La resina sembra stimolare la muscolatura liscia[112] e forse la peristalsi[113]. Stimola il tono uterino[114] e promuove il flusso ematico uterino[115].
I sesquiterpeni furanoeudesma-1,3-dieni e curzarene sono analgesici in vi[116]vosu modelli animali (bloccati da naxolone), con meccanismo forse mediato da recettori oppioidi (una spiegazione del Vinum murratum offerto a Gesù per le proprietà analgesiche?)
Cautele
In mancanza di dati completi, si sconsiglia l’utilizzo della resina di mirra in gravidanza, in allattamento e a bambini, a meno di una specifica indicazione di un professionista[117].
Dosaggio
- Tintura di Mirra (1:5; 90% etanolo)
- Topico
- Tintura pura al bisogno sulla pelle o sulle mucose orali 2-3 volte al giorno
- Colluttorio: 5–10 gocce in un bicchiere di acqua per una azione blanda, fino a 60 per attività più drastiche.
- Dentifricio in polvere: 10% di gommo-resina polverizzata.
<<<<>>>>
[82] Secondo alcuni autori Commiphora molmol era diversa dalla mirra (veniva anche chiamata mirra africana) ma l’odore del fumo era simile e per questa ragione veniva venduta come mirra. Cfr. Tucker, A. O. 1986. Frankincense and myrrh. Economic Botany 40 (4): 425–433
[83] Burfield T. Natural aromatic material – odours & origins. The Atlantic Institute of Aromatherapy, 2000
[84] Bowen, M.R. 1990. A bibliography of forestry in Somalia and Djibuti. Edition two. Natural Resources Institute for Overseas Development Administration, UK and National Range Agency, Somalia. Somali Forestry Papers No. 3
[85] Farmacopea Ufficiale del Regno d’Italia, VI edizione , 1940, Roma
[86] WHO (1999) WHO monographs on selected medicinal plants Vol 3 World Health Organization, Geneva)
[87] Tucker, A. O. 1986. Op. Cit. Langenhein J.H. (2003) Op. Cit.
[88] Arctander, S (1994) Perfume and Flavor Materials of Natural Origin. Allured Publishing Corporation
[89] Burfield T. 2000 Op. Cit.
[90] Farmacopea Ufficiale del Regno d’Italia, Op. Cit.
[91] Brieskorn CH e Noble P (1982) “Unhaltstoffe des eterischen ols de Myrrhe II. Sesquiterpene & Furanosesquiterpene” Medica 44, 87; Olhoff G. (1990) Scents & Fragrances Springer-Verlag pp132-188. Marongiu, Bruno, Alessandra Piras, Silvia Porcedda, and Andrea Scorciapino. “Chemical Composition of the Essential Oil and Supercritical CO2 Extract of Commiphora Myrrha (Nees) Engl. and of Acorus Calamus L.” Journal of Agricultural and Food Chemistry, 2005; Rahman, M , Mark Garvey, Laura Piddock, and Simon Gibbons. “Antibacterial Terpenes from the Oleo-resin of Commiphora Molmol (Engl.).” Phytotherapy Research : PTR, 2008. Hanus LO, Rezanka T, Dembitsky VM, Moussaieff A (2005) Myrrh – Commiphora chemistry. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2005, 149(1):3-28; Zhu, N, H Kikuzaki, S Sheng, S Sang, M Rafi, M Wang, N Nakatani, R DiPaola, R Rosen, and C Ho. “Furanosesquiterpenoids of Commiphora Myrrha.” Journal of Natural Products, 1, 2001
[92] Burfield T. 2000 Op. Cit.
[93] Brieskorn CH e Noble P (1982) Op. Cit.
[94] Hanus LO, Rezanka T, Dembitsky VM, Moussaieff A (2005) Myrrh – Commiphora chemistry. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2005, 149(1):3-28
[95] Duke, J.A., (2008) Op. Cit.
[96] Uphof, J. C. T. 1968. Dictionary of economic plants. New York: Verlag von J. Cramer.; Usher, G. 1974. A dictionary of plants used by man. New York: Hafner Press.
[97] Lemenih, M., T. Abebe, and M. Olsson. 2003. Gum and resin resources from some Acacia, Boswelli and Commiphora species and their economic contributions in Liban, south-east Ethiopia. Journal of Arid Environments 55 (3): 465–482.
[98] Bellakhdar, J.J. 1997. La pharmacopoée marocaine traditionelle. Médecine Arabe ancienne et savouirs populaires. Ibis Press: Paris.
[99] Sameh F. AbouZid Abdelhalim A. Mohamed (2011) Survey on medicinal plants and spices used in Beni-Sueif, Upper Egypt Journal of Ethnobiology and Ethnomedicine, 7:18
[100] Grieve, M (1971, repr. 1931) 1971 A modern herbal; the medicinal, culinary, cosmetic and economic properties, cultivation and folk-lore of herbs, grasses, New York, Dover Publications
[101] Felter, HW (1922) The Eclectic Materia Medica, Pharmacology and Therapeutics. Eclecdtics Publications, USA
[102] Miller JM, Goodell HB. (1968) Frankincense and myrrh. Surg Gynecol Obstet Aug; 127(2):360–5. Greene DA. (1993) Gold, frankincense, myrrh, and medicine. N C Med J Dec; 54(12):620–2
[103] http://www.swsbm.com/ManualsMM/MatMed5.pdf
[104] Newall CA, Anderson LA, Philpson JD. Herbal Medicine: A Guide for Healthcare Professionals. London, UK: The Pharmaceutical Press, 1996. The Review of Natural Products by Facts and Comparisons. St. Louis, MO: Wolters Kluwer Co., 1999
[105] Rahman, M , Mark Garvey, Laura Piddock, and Simon Gibbons. “Antibacterial Terpenes from the Oleo-resin of Commiphora Molmol (Engl.).” Phytotherapy Research : PTR, October 1, 2008. http://dx.doi.org/10.1002/ptr.2501.
[106] Wichtl MW. Herbal Drugs and Phytopharmaceuticals. Ed. N.M. Bisset. Stuttgart: Medpharm GmbH Scientific Publishers, 1994.
[107] Duwiejua M, Zeitlin IJ, Waterman PG, Chapman J, Mhango GJ, Provan GJ. Anti-inflammatory activity of resins from some species of the plant family Burseraceae. Planta Medica, 1993, 59:12–16. Atta AH, Alkofahi A. Anti-nociceptive and anti-inflammatory effects of some Jordanian medicinal plant extracts. Journal of Ethnopharmacology, 1998, 60:117–124. Tariq M, Ageel AM, Al-Yahya MA, Mossa JS, Al-Said MS, Parmar NS. Anti-inflammatory activity of Commiphora molmol. Agents and Actions, 1985, 17:381–382.
[108] al-Harbi MM, Qureshi S, Raza M, Ahmed MM, Giangreco AB, Shah AH.(1994) Anticarcinogenic effect of Commiphora molmol on solid tumors induced by Ehrlich carcinoma cells in mice. Chemotherapy 1994:40:337-47. Qureshi S, al-Harbi MM, Ahmed MM, Raza M, Giangreco AB, Shah AH. (1993) Evaluation of the genotoxic, cytotoxic, and antitumor properties of Commiphora molmol using normal and Ehrlich ascites carcinoma cell-bearing Swiss albino mice. Cancer Chemother Pharmacol. ;33(2):130-8.
[109] Tariq M et al. Anti-inflammatory activity of Commiphora molmol. Agents and Actions, 1985, 17:381–382. Mohsin A et al. Analgesic, antipyretic activity and phytochemical screening of some plants used in traditional Arab system of medicine. Fitoterapia, 1989, 60:174–177.
- [110] Al-Awadi FM, Gumaa KA. Studies on the activity of individual plants of an antidiabetic plant mixture. Acta Diabetologica Latina, 1987, 24:37–41.
- Ubillas RP et al. Antihyperglycemic furanosesquiterpenes from Commiphora myrrha. Planta Medica, 1999, 65:778–779
- [111] al-Harbi MM, Qureshi S, Raza M, et al. Gastric antiulcer and cytoprotective effect of Commiphora molmol in rats. J Ethnopharmacol 1997;55:141-50
- [112] The Review of Natural Products by Facts and Comparisons. St. Louis, MO: Wolters Kluwer Co., 1999. McGuffin M, Hobbs C, Upton R, Goldberg A, eds. American Herbal Products Association’s Botanical Safety Handbook. Boca Raton, FL: CRC Press, LLC 1997
[113] The Review of Natural Products by Facts and Comparisons. St. Louis, MO: Wolters Kluwer Co., 1999.
[114] McGuffin M, Hobbs C, Upton R, Goldberg A, 1997 Op. Cit.
[115] McGuffin M, Hobbs C, Upton R, Goldberg A, 1997 Op. Cit. Brinker F. Herb Contraindications and Drug Interactions. 2nd ed. Sandy, OR: Eclectic Medical Publications, 1998
[116] Dolara P et al. Characterization of the action of central opioid receptors of furaneudesma-1,3-diene, a sesquiterpene extracted from myrrh. Phytotherapy Research, 1996, 10:S81–S83. Atta AH, Alkofahi A. Anti-nociceptive and anti-inflammatory effects of some Jordanian medicinal plant extracts. Journal of Ethnopharmacology, 1998, 60:117–124
[117] British herbal pharmacopoeia. Exeter, British Herbal Medicine Association, 1996. Saha JC, Savini EC, Kasinathan S. Ecbolic properties of Indian medicinal plants. Part I. Indian Journal of Medical Research, 1961, 49:130–151. Pernet R. Phytochimie des Burseraceae. [Phytochemistry of the Burseraceae.] Lloydia, 1972, 35:280–287.










 -hemolysin (the major hemolysin to cause hemolysis). In addition, this suppression was also evaluated at the transcriptional level via real-time reverse transcription (RT)-PCR analysis. The transcriptional analysis indicated that 128 µg/ml of eugenol remarkably repressed the transcription of the S. aureus sea, seb, tst, and hla genes. According to these results, eugenol has the potential to be rationally applied on food products as a novel food antimicrobial agent both to inhibit the growth of bacteria and to suppress the production of exotoxins by S. aureus.
-hemolysin (the major hemolysin to cause hemolysis). In addition, this suppression was also evaluated at the transcriptional level via real-time reverse transcription (RT)-PCR analysis. The transcriptional analysis indicated that 128 µg/ml of eugenol remarkably repressed the transcription of the S. aureus sea, seb, tst, and hla genes. According to these results, eugenol has the potential to be rationally applied on food products as a novel food antimicrobial agent both to inhibit the growth of bacteria and to suppress the production of exotoxins by S. aureus.