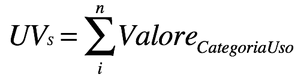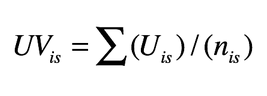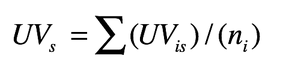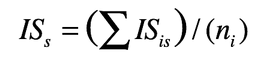Dopo tre anni di passione e preparazione, dopo mesi di distillazione, il passaggio dal progetto OfficinaLessinia al marchio Gadoi è fatto. Siamo finalmente approdati alla fase finale, quella della commercializzazione dei prodotti da filiera locale, ossia oli essenziali ed acque aromatiche da piante biologiche e/o da raccolta spontanea sostenibile. Al momento offriamo un listino che si compone di 12 oli essenziali ed acque aromatiche provenienti dalle montagne della Lessinia (Verona) e 4 oli essenziali della Sardegna. Con il 2017 contiamo di aggiungere alcuni oli essenziali selezionati provenienti dalle filiere controllate del Nepal che abbiamo visitato nel 2016 e che visiteremo nell’anno prossimo. Sempre nel 2017 offriremo miscele funzionali di oli essenziali per applicazioni topiche e per assunzione orale in forma di microincapsulati gastroprotetti. Siamo orgogliosi di offrire solo piante locali, sia derivate dal pool genetico del territorio, sia da una selezione di cultivar o chemiotipi che abbiamo selezionato per la loro adattabilità. Il lancio ufficiale del sito di e-commerce e del database sugli oli essenziali (www.gadoi.it) avverrà a fine gennaio, e da quel momento sarà possibile accedere liberamente ai dati gas-cromatografici dei singoli lotti di oli essenziali ed acque aromatiche, oltre che ai riferimenti in letteratura sulle caratteristiche dei prodotti. Per chi fosse interessato al listino prezzi prima della pubblicazione del sito, è possibile riceverlo contattandoci alla mail info@gadoi.it Ringraziandovi per l’interesse mostrato per il nostro progetto, vi auguro Buone Feste.
Archivi categoria: Uncategorized
Qualche corso qua e là…
Aggiorno gli interessati sui corsi che terrò nel prossimo futuro:
- Venerdì 28 Marzo sarò in quel di Arezzo presso il 7° Forum della FIPPO a parlare di oli essenziali e delle loro applicazioni, qui trovate il programma con tutti gli altri relatori.
- Lunedì 3 Marzo inizia invece a Verona il corso (in quattro seminari) sulla trasformazione delle piante officinali, un corso teorico-pratico pensato specialmente per gli erboristi ma aperto a tutti gli interessati. I seguenti seminari saranno il 17 e 31 Marzo ed il 14 Aprile. Qui sotto la scheda di iscrizione della SISTE.
- Il 16 Marzo sarò a Bologna allo Smell Atelier con due seminari, uno alla mattina sugli utilizzi degli olii essenziali e uno al pomeriggio sul tema delle resine e degli incensi nella storia. Qui il link alla presentazione. Il 6 Aprile sarò di nuovo allo Smell Atelier a parlare prima di neurogastronomia e poi di spezie.
Otto seminari otto
Negli anni ho tenuto vari corsi sulle piante medicinali, primariamente indirizzati a studenti/esse di Tecniche Erboristiche, ad erboristi/e, a farmacisti/e e medici.
In fase di progettazione dei corsi ho sempre cercato di inserire una parte dedicata alla metodologia di ricerca e agli strumenti di analisi delle evidenze, ma questo approccio non ha mai incontrato un grande successo, e posso capirne il perché: a causa del tempo limitato che i professionisti riescono a dedicare all’aggiornamento, spesso la tentazione è di accumulare quante più informazioni possibili da poter spendere praticamente nel lavoro quotidiano. Discorsi teorici sulla validità delle evidenze, sul loro reperimento, sulla loro valutazione possono sembrare solo ostacoli e ritardi inutili, in fondo chi viene a seguire il corso implicitamente considera il docente come fonte attendibile.
Io penso invece che, in un’ottica che vada al di là dell’immediatamente utile, tale approccio vada ripensato. Proprio perché il tempo (ed i soldi) sono limitati è utile sviluppare in proprio gli strumenti che ci permettono di formarci da soli una opinione sulle informazioni che riceviamo, senza dovere ogni volta iscriversi ad un altro corso che darà informazioni sparse che inevitabilmente saranno obsolete nel giro di relativamente poco tempo. Se questo discorso vale per tutti i professionisti, vale a mio parere ancora di più per gli erboristi.
A differenza di medici e farmacisti, chi lavora con le piante medicinali ha un corpus di evidenza sul quale basare le proprie decisioni più limitato e di qualità più variegata. Inoltre le fonti di evidenza sono più diversificate, non essendo limitate a dati sperimentali e clinici, ma comprendendo anche dati storici ed etnobotanici. Gli erboristi non hanno quindi a disposizione facili ed esaustivi formulari, e devono spesso valutare da soli l’importanza di un dato, e devono inoltre possedere diverse competenze per decifrare lo scenario.
Inoltre l’impressione che mi sono fatto in questi anni è che spesso chi lavora nel campo erboristico mantiene un atteggiamento diffidente e pregiudiziale nei confronti della “Scienza”.
Seppure possa capire da dove proviene questo sentimento, credo che esso sia ingiustificato, e che in realtà impedisca di mettere in campo critiche serie al modo in cui la ricerca viene fatta. Come non mi stanco di ripetere, l’unico modo per pretendere che i dati storici sulle piante medicinali vengano presi seriamente in considerazione è di essere scientificamente stringenti e metodologicamente esigenti (ho coperto questi argomenti in una serie di post su questo blog, in particolare in Indici quantitativi, Indicazioni tradizionali, e Uomo e piante)
Tutto questo per dire che sono molto contento che la S.I.S.T.E. abbia accettato la mia proposta di un corso di otto seminari sulle piante medicinali, i cui due primi appuntamenti saranno interamente dedicati alla problematica dei metodi di ricerca scientifica, e al problema di come valutare ed utilizzare i dati provenienti da storia della medicina ed etnobotanica.
I seminari si terranno a Milano, presso la sede della S.I.S.T.E., i lunedì, dalle 10.00 alle 13.00 e dalle 14.00 alle 17.30, con il seguente calendario: 15 Aprile; 13 Maggio; 27 Maggio; 10 Giugno; 16 Settembre; 14 Ottobre; 11 Novembre; 16 Dicembre.
E’ possibile scaricare il programma dei seminari e la domanda di iscrizione qui.
Il corso sarà diviso in due parti, la prima dedicata, come già accennato, alle basi della ricerca, mentre la seconda cercherà di delineare lo stato dell’arte sulle piante medicinali che hanno una base di evidenza più solida, dividendo gli argomenti per apparato.
Di seguito il programma completo.
Seminario 1. (15/4) La ricerca in fitoterapia.
Le basi: la logica della ricerca.
Scienza: non una vacca sacra e neppure un “discorso” tra tanti. Demistificare per valutare.
Breve introduzione alla scienza con il metodo del riepilogo storico.
Cosa è il metodo scientifico? Ovvero, esiste un metodo scientifico? Alcune ragioni per dubitare ma non per disperare. Tentativi di inquadramento dei termini chiave.
Il problema della demarcazione, ovvero, di chi mi devo fidare anche se fa male?
Le basi: la logica della medicina
– Cause
– Malattia e normalità
– Credere, dubitare e sospendere il giudizio
– Prove
– Bias
– Confounding
Seminario 2. (13/5) Gli strumenti a nostra disposizione
Le fonti di informazione a nostra disposizione e più rilevanti per la fitoterapia
– Ricerca storica ed etnobotanica
– Fitochimica ed evoluzione
– Studi in vitro ed in vivo
– Studi clinici
– Metastudi
– Limiti e punti di forza dei vari studi.
L’interpretazione dei dati
– Cenni di epidemiologia
– Come leggere gli studi e come attribuire valori di evidenza e di rilevanza agli studi
– Come costruire una gerarchia delle evidenze
– Cenni ai problemi più generali della ricerca.
Seminario 3. (27/5) Stato dell’arte della ricerca sulle piante.
– Una visione sullo stato dell’arte: definizioni.
– Le piante con maggiori livelli di evidenza per l’efficacia
– I dati tossicologici
– Interazioni negative e positive
Gli utilizzi delle piante e gli apparati.
Ogni seminario presenterà brevi cenni di fisiopatologia dell’apparato/sistema in questione, ed esaminerà le piante rilevanti che abbiano un sufficiente supporto clinico e sperimentale, oltre a suggerire quali altre piante potrebbero essere utili seppure con un supporto minore.
Seminario 4. (10/6)
– Tonici ed adattogeni
– Antibiotici, immunomodulanti.
Seminario 5. (16/9)
– Apparato gastrointestinale: problemi funzionali (dispepsia, sindrome dell’intestino irritabile, reflusso), gastrite, stipsi, diarrea, disbiosi, problemi epatobiliari
– Apparato genito-urinario: le infezioni del tratto urinario, disturbi funzionali della minzione, iperplasia prostatica benigna, calcolosi
Seminario 6. (14/10)
– Apparato cardiocircolatorio: ipertensione, aritmie, palpitazioni, insufficienza venosa cronica.
– Metabolismo: dislipidemie, disglicemie, prediabete, sindrome metabolica
Seminario 7. (11/11)
– Apparato muscoloscheletrico: dolori reumatici, traumi, dolori muscolari
– Apparato nervoso periferico e centrale: ansia, stati depressivi, insonnia,
Seminario 8. (16/12)
– Apparato tegumentario: acne, eczema, psoriasi, micosi cutanee.
– Apparato respiratorio: le malattie da raffreddamento, le bronchiti, la tosse, otite, sinusite, rinite allergica
Indici quantitativi in etnobotanica
Nel post precedente (qui) ho iniziato a parlare del problema della valutazione e dell’utilizzo dei dati etnobotanici e storici. Ho analizzato uno dei punti critici del processo di indagine, cioè la valutazione quantitativa della segregazione delle piante medicinali nelle famiglie botaniche, concludendo che questa segregazione esiste e sembra indicare una scelta non casuale delle piante da parte dei gruppi umani. Quali poi siano le ragioni per questa scelta è naturalmente un problema più complesso, e che quasi certamente non permette risposte mono-causali.
E’ stato proposto [1] che gli schemi di classificazione che osserviamo nelle e tra le società siano il risultato di:
- predisposizioni cognitive universali risultanti dall’evoluzione.
- l’oggettiva struttura tassonomica del bioma locale che non possiamo fare a meno di riconoscere.
- interpretazioni culturali relative.
- meri artefatti dei metodi di ricerca.
Il sapere tradizionale
Ma prima di affrontare questo argomento è necessario evocare il convitato di pietra di questa discussione, cioè il “sapere tradizionale” (o sapere ecologico tradizionale, o sapere locale, come è stato variamente definito). Fino ad ora, e nel post precedente, per comodità di trattazione ho usato questo termine (d’ora in poi ST) come se non esistessero ambiguità rispetto alla sua definizione, alla sua estensione, alle sue origini. Ma è utile soffermarci di più sulla sua articolazione all’interno della ricerca in etnobotanica, perché è essenziale per l’esplorazione del rapporto tra dati storico-etnobotanici ed efficacia biologica, ed inoltre perché è proprio sull’interpretazione del termine e sul sull’utilizzo da fare del “sapere tradizionale” che spesso casca l’asino della discussione erboristica/fitoterapica.
Partiamo intanto con una definizione preliminare tratta da un articolo di Victoria Reyes-García del 2010. L’autrice definisce il ST o i sistemi di sapere tradizionale come: “il sapere sulle risorse e le dinamiche dell’ecosistema, e le pratiche di gestione ad esso associate esistenti tra i membri della comunità che, giornalmente e per lunghi periodi di tempo, interagiscono per il proprio benessere e per la coesistenza con l’ecosistema stesso”. Secondo l’autrice il ST include non solo informazioni sugli usi umani di piante ed animali, ma anche sistemi di classificazione, osservazioni sull’ambiente locale e un sistema di utilizzo e gestione delle risorse, oltre a credenze su esseri non umani, sovrannaturali, e sulle relazioni che essi intrattengono con la società. In definitiva il sapere tradizionale deve essere inteso come in modo di comprendere il mondo o la “cultura”.Esso rappresenterebbe un tratto culturale adattivo per le popolazioni che favorisce la loro sopravvivenza, la produzione di cibo, la costruzione di ripari e in genere il controllo sulle proprie vite. Verrebbe sviluppato e continuamente adattato ad un ambiente in continuo cambiamento, e verrebbe passato di generazione in generazione non isolato bensì strettamente intrecciato a valori culturali ed etici.
L’altro
Vista questa definizione, torniamo a bomba al problema dello status dei dati storici ed etnobotanici. Quello che a mio parere è uno dei problemi più diffusi in questo ambito è la tendenza a polarizzare i termini del dibattito seguendo una antica tendenza della discussione sull’altro o sull’alterità, cristallizzata dall’antropologia settecentesca intorno all’alternativa “buon selvaggio” (preservato dalla corruzione della civiltà grazie alle sue doti naturali) o “cattivo selvaggio” (immerso nella miseria e depravazione a causa della sua ignoranza e pigrizia).
Succede infatti spesso che l’altro erboristico (sia esso il medico antico che seguiva i dettami della sua tradizione di medicina colta, o sia esso il guaritore contemporaneo che in una società distante utilizza rimedi della foresta) venga costruito secondo una immagine idilliaca, con un discorso impressionistico e poco rigoroso. Si richiama, con modalità talvolta ingenua e nostalgica, un passato nel quale si potrebbero ritrovare le origini più vere, la vicinanza alla fonte, qualcosa di “originario” che il presente, il progresso e la modernità ci hanno tolto. Oppure si cerca nelle popolazioni esotiche e nelle loro culture “la silhouette mobile e vaga di un selvaggio che, più vicino di noi alla natura, avrebbe rifiutato in anticipo tutto ciò che ci opprime e del quale si troverebbe ancora traccia, ricordo o testimonianza nella foresta amazzonica o nel deserto australiano” (vedi ad esempio Marc Augè).
Termini che vengono spesso usati in questo contesto sono tradizione, radici, origine, memoria, ecc., ma raramente gli autori che li usano si fermano a pensare al perché essi vengano usati, ed in che modo. Questo ragionamento schematico e dicotomico, etnocentrico al rovescio, contribuisce ad imprigionare l’altro, a sottometterlo alla nostra rappresentazione. Spesso in questo dibattito si fa uso del termine e della metafora delle radici [2], che richiama il tema delle origini, che in quanto origini sembrano più importanti, imprescindibili, contenenti in nuce ciò che da esse si svolge [3]. Ma come dice Galimberti:
“Essere più vicini alla fonte non significa custodire qualcosa di “originario”, ma essere semplicemente all’inizio di un processo: la storia, che si compie facendosi, e non abolendola dissetandosi alla fonte. All’inizio c’è solo l’avvio, e non il senso nascosto, o il silenzio custodito da ciò che in seguito si dispiegherà. E solo il rifiuto del mondo che viviamo può far ritenere che il mondo antico, con il suo corredo di simboli, disponga di segni più veri. Ma rifiuto e nostalgia sono i moti dell’anima di chi disabita il mondo che per sorte si trova ad abitare, non sono certo criteri di giudizio, ne tantomeno sentieri di verità”.
Quantificazione
Fatta questa doverosa premessa circa l’atteggiamento metodologico da tenere quando siamo confrontati da dati storici ed etnobotanici, rimane l’aspetto tecnico, interno diciamo all’etnobotanica. Cosa significa il termine sapere tradizionale o i suoi cognati? E’ possibile quantificarlo? E se si, come?
La quantificazione del sapere tradizionale è stata tentata attraverso l’utilizzo di indici di misura dell’importanza culturale delle piante, i cosiddetti indici di Importanza Culturale Relativa [RCI]. Questi indici quantitativi si usano in etnobotanica per comparare usi e importanza culturale dei differenti taxa. Sono stati usati in vari studi e la loro utilità risiede in prima istanza nel fatto che su di essi si possono effettuare analisi statistiche di vario tipo per comparare diverse specie tra loro, zone vegetazionali, habitus, taxa, ecc. Essi inoltre permettono di ottenere valori numerici integrabili ad altri indici (tassonomici, fitochimici, ecc.) utilizzabili per comparazione trans-culturali e per testare differenti ipotesi.
Gli indici RCI si sono moltiplicati negli ultimi anni, ma mi soffermo in questo momento su tre gruppi di indici che sono particolarmente importanti.
1. Indici di totalizzazione degli usi
Semplici indici enumerativi, che elencano usi e non usi per ogni pianta. Un esempio è UT
Dove UT è pari alla semplice sommatoria di tutti gli usi conosciuti per ogni specie, che possono essere categorizzati per utilità, per taxon vegetale o per tipo vegetazionale. Questi metodi non tentano di misurare i livelli di importanza per i differenti usi e non tengono conto del consenso tra gli informatori. Il taxon più importante è semplicemente quello con le maggiori citazioni d’uso. Dal punto di vista della possibilità di catturare la complessità dell’oggetto sapere tradizionale (e della misura dell’importanza culturale) questi indici non offrono molto, e dal punto di vista della rilevanza statistica e della possibilità di testare delle ipotesi sono i meno efficaci. Non registrando la provenienza dell’informazione (da quale informatore) non permettono di valutare la variabilità intraculturale. Non tenendo in conto l’esistenza di livelli diversi di importanza, il metodo è eccessivamente sensibile all’intensità della campionatura (una pianta con molti utilizzi tutti poco importanti nel gruppo studiato peserebbe di più di una pianta con meno utilizzi ma molto più importanti). Per ovviare almeno in parte a questi deficit, sono stati sviluppati dei metodi più sofisticati, come quelli detti di assegnazione soggettiva dell’importanza.
2. Indici di assegnazione soggettiva
Indici simili a quelli precedenti, ma con modificatori di importanza basati sulle valutazioni e sulla conoscenza del contesto da parte del ricercatore. Questi indici pesati permettono la misura dei gradi di importanza ma introducono un pregiudizio del ricercatore che rende più difficile l’utilizzo degli indici, ad esempio nella analisi bibliografica. Un esempio è quello del Valore d’Uso (UVs)
UVs deriva da UT ma somma i punteggi generati dal ricercatore per ogni utilizzo (importante = 1 punto; poco importante = 0,5 punti).
Gli indici che sono stati più influenti nei decenni recenti sono però senza dubbio stati gli indici di consenso.
3. Indici di consenso tra gli informatori
Indici basati sul consenso tra gli informatori, con pesi dati agli usi generati dal ricercatore o dall’informatore. Questi indici si basano sulla teoria del consenso culturale (CCT), una teoria antropologica sviluppata per stimare la risposta culturalmente corretta in differenti domini del sapere tradizionale. La CCT parte dagli assunti che esista una risposta culturalmente corretta per ogni domanda [4], che il sapere consista nell’accordo tra informatori [5], e che la probabilità che un informatore risponda in maniera corretta ad una determinata domanda sia il risultato della sua competenza in quel dominio di sapere [6]. Si tratta quindi di un metodo che misura il sapere in termini di congruenza con un modello esplicativo proprio del gruppo studiato. Da ciò deriva l’ipotesi che maggiore la salienza di una pianta o di un suo utilizzo in una comunità, maggiore sarà la frequenza di citazione della pianta.
Qui sotto riporto alcune delle formule più usate.
1. Valore d’uso delle specie per un informatore:
Dove UVis = numero di usi menzionati per la specie s dall’informatore i; n is = numero di interviste nelle quali l’informatore i menziona un uso per la specie s.
2. Valore d’uso di una specie per tutti gli informatori
Dove ni = numero totale di informatori intervistati per la specie s. Questo indice misura il numero di usi attribuiti ad un taxon relativo al numero di informatori che citano il taxon, cioè misura l’importanza del taxon se per importanza intendiamo la sintesi degli usi. Alcuni autori hanno infatti riscontrato una correlazione positiva tra numero di informatori che considerano importante una specie s, l’indice UV, e il numero di utilizzi, ed hanno concluso che l’importanza è una sintesi della molteplicità degli usi di un taxon. Altri autori preferiscono legare l’importanza sia al numero di usi sia a quanto bene è conosciuta la pianta.
UVs può essere ritenuta rilevante quando tanti informatori citano molti utilizzi, ma può essere fuorviante se vi è un solo informatore che cita molti utilizzi, oppure se una pianta è oggettivamente molto importante, ad esempio una pianta simbolo stesso della società studiata, ma ha pochi usi. Teoricamente gli indici basati sul consenso degli informatori dovrebbero favorire quei taxon con un elevato livello di consenso in una cultura, ma un indice come UV è ancora molto crudo.
3. Metodo del punteggio dell’informatore
All’uso di una pianta viene assegnato dall’informatore un punteggio variabile da 0,5 (utilizzabile ma sub-ottimale) a 1,5 (quasi ottimale) in cinque categorie. Questi punteggi vengono sommati per ottenere un punteggio finale, per una singola intervista, nella forchetta 0-7,5. ISis si calcola come il punteggio medio per tutte le interviste, e ISs si ottiene come la media tra i valori d’uso per tutti gli informatori.
Criticità
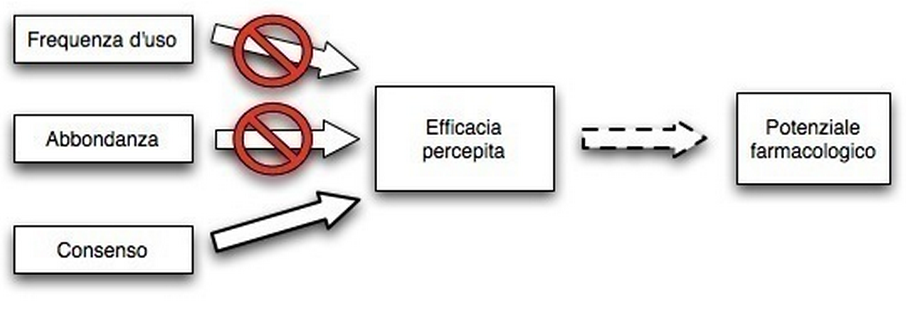
Tutte queste tecniche condividono l’assunto che gli indici misurino il sapere tradizionale, e che l’estensione del sapere tradizionale su una pianta in una data cultura ci dia una misura indiretta dell’importanza culturale percepita di tale pianta in maniera più oggettiva degli altri indici. Inoltre, quando gli indici vengono utilizzati a scopo euristico, per delimitare taxa specifici per la ricerca etnofarmacologica, ci si basa sull’assunto che vi sia un legame tra importanza culturale, sapere tradizionale, efficacia percepita e potenziale farmacologico.
Ognuno di questi passaggi presenta delle criticità.
- Il rapporto tra indici RCI ed efficacia percepita potrebbe non essere lineare. Vi è ad esempio il ruolo della disponibilità delle piante che può confondere questo rapporto.
- Esistono molte discrepanze tra dati ottenuti con metodi differenti, discrepanze che rivelano come il sapere tradizionale comprenda molte dimensioni e campi differenti, rendendo difficile incapsularlo in un’unica definizione derivante da un unico metodo.
- Esistono discrepanze tra “sapere attivo” (quali piante vengono usate dalle persone) e “sapere passivo” (cosa le persone sanno sull’utilizzo delle piante)
- La correlazione tra sapere e consenso potrebbe non essere lineare e semplice, e potrebbe dipendere:
4.1. dal fatto che stiamo studiando piante medicinali o piante alimentari o piante medicinali e alimentari.
4.2. Da chi decidiamo di intervistare come informatore (guaritore, bambini, uomini, donne, ecc.). Gli etnofarmacologi si sono quasi sempre concentrati sui guaritori professionisti perché li ritenevano i più profondi conoscitori della materia, ma se professionisti e gente comune non condividono lo stesso corpus di sapere, allora restringere la ricerca ad un solo gruppo limita e rende pregiudiziale il tipo di informazione raccolta
4.3. Dalla differenza tra sapere condiviso e sapere idiosincratico
Casagrande mette anche in dubbio l’assunto che le piante usate più di frequente siano anche quelle percepite come più efficaci. L’autore arriva a questa conclusione dopo avere riscontrato nel suo studio sul campo che:
- L’abbondanza di una specie è collegata alla frequenza d’uso, mentre la frequenza d’uso non è collegata all’efficacia percepita; secondo l’autore questo indica che le prime piante ad essere utilizzate in caso di malattia sono le più disponibili, le più abbondanti nella vicinità delle zone abitate, a prescindere dalla loro efficacia. Le piante più efficaci (efficacia emica) vengono usate solo in caso le prime non risolvano il problema. Visto che la severità dei sintomi può scemare anche senza intervento, è probabile che in molti casi le piante più efficaci non verranno utilizzate.
- L’efficacia percepita e, in misura minore, la frequenza d’uso, sono correlati alla distribuzione del sapere, ma l’organizzazione sociale, i fattori cognitivi individuali e distribuiti, i processi di trasmissione culturale strutturata e random danno forma al processo di disseminazione. A parte poche piante e malattie molto comuni, la distribuzione del sapere sarà spesso random o non prevedibile.
Questi risultati mettono in crisi il postulato di molta ricerca quantitativa che suppone che frequenza d’uso, distribuzione del sapere e/o consenso tra informatori si correli bene con l’efficacia percepita, e mette quindi in dubbio la correlazione tra indici RCI ed efficacia emica. I risultati metterebbero anche in dubbio l’ipotesi che le piante più disponibili siano più utilizzate perché conterrebbero più composti interessanti (come voleva Moerman): le piante più disponibili verrebbero più usate semplicemente perché sono più disponibili.
Sarebbe quindi meglio misurare direttamente l’efficacia percepita, ma anche il legane tra efficacia percepita e potenziale farmacologico non è netta, perché le informazioni variano tra le popolazioni, è quindi necessario comparare diverse comunità in aree geografiche diverse e preferibilmente lontane.
Quindi, secondo Casagrande i rapporti tra frequenza d’uso e abbondanza di una pianta non sono indicatori forti dell’efficacia percepita, mentre il consenso lo è, e comunque l’efficacia percepita ha un legame debole con il poitenziale famacologico se non viene analizzata a livello transculturale (vedi il prossimo post).
Questo non significa che, secondo Casagrande, le piante usate dalle popolazioni non siano mai efficaci, ma che gli schemi di distribuzione del sapere non rappresentano una corrispondenza ottimale tra bisogni indotti dalla malattia e i composti fitochimici disponibili nell’ambiente.
Il prossimo post si concentrerà su due articoli che descrivono due applicazioni molto diverse tra loro degli indici, ma che ci possono servire per capirne meglio l’utilità.
————————————————————————————————————————————————————————————————–
Note
[1] Casagrande, David 2004 Ethnobiology lives! Theory, Collaboration, and Possibilities for the Study of Folk Biologies. Reviews in Anthropology, vol. 33, pp. 351 to 370
[2] Una metafora molto potente perché mentre nessuno ha mai visto una tradizione o una identità, tutti hanno visto delle radici.
[3] Lo stesso concetto di tradizione viene presentato come monolitico e fisso. In effetti se non fosse presentato in questo modo non potrebbe svolgere il compito che gli viene richiesto, quello di “ancorare” le pratiche presenti ad un passato “naturale” che le giustifichi. Ma questa visione, di nuovo piuttosto ingenua, non rende conto del carattere costruttivo e dinamico della tradizione e della memoria collettiva che hanno bisogno di una serie di cornici di riferimento a carattere sociale che ne condizionano fortemente i contenuti. Al mutare dei quadri sociali muta la memoria. La memoria collettiva e la tradizione culturale si creano attraverso un processo di ricostruzione artificiale (vedi il Palio di Siena, la topografia leggendaria dei Vangeli in Terra Santa, la costruzione delle differenze etniche tra Hutu e Tutsi) (Halbwachs (1987) La memoria collettiva, Unicopli, Milano). Proprio gli antichi sembravano ben avvertiti del carattere dinamico e non monolitico della tradizione, incapace da sola a fondare una identità: Cicerone (De legibus, 2, 16, 40) racconta che un’ambasciata ateniese si recò a Delfi per chiedere ad Apollo quali riti sacri mantenere e quali no. L’oracolo rispose: eos quae essent in more maiorum, cioè “quelli conformi al costume degli antenati”, ovvero “tenetevi alla vostra tradizione”. Ma gli ateniesi tornarono poco dopo per ottenere maggiori delucidazioni sul significato dell’indicazione: infatti il costume degli antenati era mutato molte volte, quale era la tradizione che dovevano ritenere quella valida? Al che Apollo rispose: “la migliore”, rivelando che la tradizione non è ne fissa ne monolitica, cambia e si costruisce, e alla fine la scelta si basa su criteri utilitaristici, non sull’antichità.
[4] Nel senso che la realtà culturale, definita come la risposta data dalla maggior parte delle persone, è la stessa per tutti gli informatori (o le fonti di informazione, in caso si lavori su testi.
[5] Il livello di accordo tra informatori riflette il loro accordo congiunto
[6] Se consideriamo la competenza come la percentuale di riposte corrette.
The Sacramento Bee

Avevo visto questa serie, vincitrice del Pulitzer nell’edizione 2007 per la fotografia, alla sua uscita, e per molto tempo ho pensato se postarla o meno, adesso mi sono deciso.
Digestive Functional Foods 5
Ed eccoci alla penultima installazione (qui, qui, qui e qui le altre), dove andremo a vedere in qualche dettaglio il funzionamento dei recettori per l’amaro e per il pungente nel tratto gastrointestinale.
—————————————————————————————————————–
Coevolution and gut sensorium
Since the discovery of secretin, the first gut hormone, by Bayliss and Starling, the idea that the gastrointestinal tract had luminal chemo-sensitivity became a serious hypothesis, and since then it has become an integral part of the model of neurohumoral control of gastrointestinal function. It implies the idea that the gastrointestinal mucosa has a sensory role via tastant-sensing cells distributed in the gastric antrum or duodenal mucos. These cells can interact with luminal nutrients and release hormones in an endocrine or paracrine manner to transfer information about luminal nutrient content to other organs, including the brain, via endocrine or subepithelial neurons and vagal pathways.[1]
The gastrointestinal tract can thus be seen as a sense organ that has coevolved with some phytochemicals (nutrients, toxins, and stimulants such as bitter or pungent compounds), and which allows the detection of these phytochemicals and the appropriate response to them, like vomiting, aversion, regulation of appetite and satiety, alteration of stomach and intestinal motility and secretions. It also allows us to integrate this local information with higher level neurohumoral messages, and to command dietary, digestive, metabolic responses, and alarm responses in case of toxins.[2]
Much recent research has focused on identification of the cell types and specific receptors involved in this sensory mechanism. Particularly important are the enteroendocrine cells of the gastrointestinal tract.[3]

They act as primary chemoreceptors by releasing signaling molecules in response to changes in the luminal environment, showing at least two levels of action:
• transduction of luminal factors by release of signaling molecules, with paracrine actions on neighboring enterocytes, pivotal for digestion and food intake control.
• integration of sub-epithelial neurons, in particular receptors at afferent terminals in vagal and spinal pathways, providing an important link in the afferent transfer of information from gut surface to nervous system.
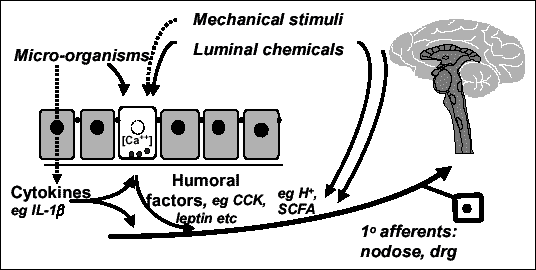
Enteroendocrine cells comprise cells producing cholecystokinin (CCK) (in duodenum and jejunum), glucagon-like peptide 1 (GLP-1) or peptide YY (PYY) (in ileum and colon), and also histamine and serotonin-producing[4] enterochromaffin-like cells.[5] These last ones are the predominant enteroendocrine cells, and they play a very important role in the regulation of gastrointestinal secretions, motility and visceral pain, mainly via serotonin secretion (involved in peristalsis, gastric motility and postprandial pancreatic secretion).[6]
These data give experimental support to the hypothesis that odor and taste are important clues for recognizing and classifying medicinal plants cross-culturally[7]. This hypothesis has been formalized by Shepard[8] when he proposed “sensory ecology” as a new theoretical framework for a cross-cultural understanding of sensation. “…[S]ensory ecology would be equally interested in cross-cultural variation and similarities and should incorporate physiological understandings and cultural constructions of sensory perceptions within a broad biocultural model addressing human-environment interactions”.
Let’s now have a look at the most important receptor families: bitter and pungent.
Bitter receptors
In Homo and in mammals, the capacity to detect the presence of toxic substances is strongly associated with the development of bitter receptors (taste receptor type 2 — TAS2R) in the oral cavity, an evolutionary-conserved mechanism to prevent ingestion of bitter-tasting compounds which are very often dietary toxins (e.g. alkaloids, saponines, etc.). This explains the fact that bitter is one of the few innate sensations universally recognized as disgusting and inducing aversive reactions.[9]
Bitter taste receptors were thought to have only gustatory functions, and to be limited to the oral cavity, but in the last 10 years there have been various reports of the presence of the receptors in extraoral sites, with non-gustatory functions. In particular TAS2Rs are well expressed in the gastrointestinal (endocrine cells in the mucosa of the gastric antrum and fundus, duodenum and gastroendocrine cells),[10] where they could regulate metabolic and digestive functions,[11] and possibly prevent the absorption of toxic compounds swallowed despite the bitter-detecting mechanisms in the mouth.[12]
While some TAS2R appear to be high selective, these are not the only ones linked to bitter sensations; there is evidence of less specific receptors that respond to relatively high concentrations of several unrelated bitter ligands, a mechanism which might explain how few receptors mediate the perception of numerous bitter compounds. This mechanis might have evolved to protect organisms from ingesting any of an enormous set of unrelated chemical potentially toxic compounds.
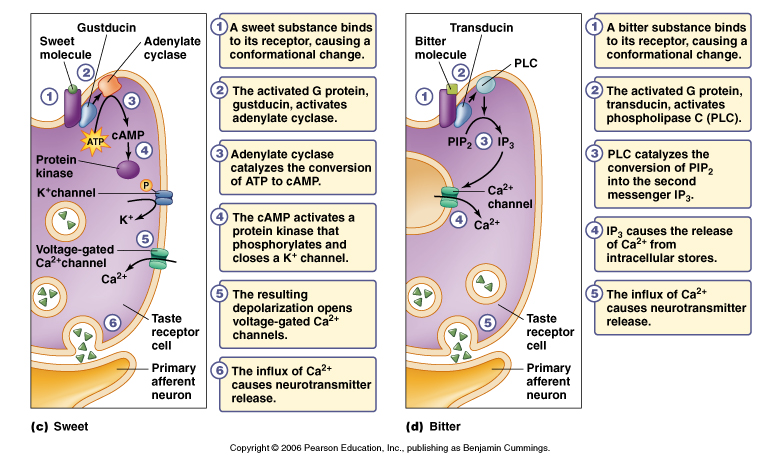
Some of the chemical characteristics of compounds which act as agonists at bitter receptors[13] are the presence of:
• phenyl-β-D-glucopyranosides (their affinity decreased approximately 200-fold when the phenyl group was replaced by a methyl moiety)
• glicoside formed by an aglycon attached to a gluco- or mannopyranose moiety in the β-glycosidic configuration.
• aglycons with one or two aromatic rings (stronger agonist properties than a methyl group)
• compounds containing an –N=C=S group.
Some of the secondary plant metabolites with agonist activity[14] are:
• aristolochic acid
• cyclohexamide
• naphthalaldehydic acid
• naphthoic acid
• nitrolnaphthalene
• papavarine
• picrotin
• picrotoxinin
• piperonylic acid
• quinacrine
• salicin
• strychnine
• α-thujone
Moving from the realm of molecules to that of plants, let us take as an example a very common weed, Dandelion (Taraxacum officinale). The sesquiterpene lactones of the eudesmanolide and germacranolide type unique to Taraxacum are intensely bitter; the elicited sensation of bitterness correlates well with the potentially poisonous nature of sesquiterpene lactones, often highly irritating for the nose and throat mucosa (hence the name sneezeweed given to many of the plants containing these substances) and cytotoxic. Although the lactones of the eudesmanolide type do not seem to posses toxic activity, they still elicit the bitterness response.
Effects of the stimulation of bitter receptors
The ingestion of relevant quantities of bitter substance will provoke a delay in gastric emptying in the subjects, followed by nausea and at times emesis.[15] Lower doses of bitters are still perceived as disgusting and this perception helps to fix the offensive food in the memory; the elicited chain of reactions is too weak to provoke emesis, but still strong enough to elicit a biliary stimulation.[16]
The activation of TAS2R in the gastrointestinal tract promotes the release of GI peptides via the protein gustducin – in particular CCK, and perhaps also PYY and GLP-1 – that can in turn activate neural reflexes.[17]
The stimulation of CCK secretion in turn triggers the release of digestive enzymes from the pancreas and the emptying of bile salts from the gallbladder into the duodenum, which then induce protein and fat digestion. CCK release also regulates gastrointestinal motility, and gastric acid secretion, induces reflex inhibition of gastric emptying (although it does not significantly impair antral motility),[18] and causes satiation by stimulating vagal afferent endings by activating CCK-1 or CCK-A receptors.[19]
Since CKK secretion is also influenced by a transcription factor (SRBEP) that is a key regulator of lipid metabolism, and since a diet rich in vegetables is usually both low in cholesterol and higher than normal in bitter substances, CKK activity seems aimed at reducing the absorption of the bitter compounds (reduced appetite, delayed gastric emptying) and of maximizing the absorption of complex carbohydrates and of low levels of essential fatty acids and fat-soluble vitamins (stimulation of gall-bladder contractions, increase in bile acid excretion).[20]
Stimulation of these receptors seems also to modulate glucose homeostasis, helping in the regulation of glucose and insulin levels.[21]
Pungent receptors
Pungency, like bitterness, is universally recognized as aversive, causing sensations of burning and pain.
A set of ion channels (Transient Receptor Potential channels — TRP channels) expressed in the gut responds to a varied class of pungent compounds. It includes the vanilloid channel TRPV1 which responds to capsaicine, piperine, allicin,[22] camphor and endocannabinoids,[23] the melastatin channel TRPM8 which responds to menthol and 1,8-cineole,[24] and the TRPA1 channel (highly expressed in human enterochromaffin cells) which responds to mustard oil, methyl salicylate, eugenol and cinnamaldheyde.[25]

After ingestion, these compounds act at esophageal level first, and then at gastric and duodenal level, stimulating gastric secretions with a general digestion-enhancing effect. Piperine increases pancreatic activity and reduces the intestinal transit time, while TRPA1 stimulation at duodenal level seems to mediate the release of CCK.[26]
Capsaicin activates TRPV1 receptors in the duodenum, which can also be activated and sensitized by acid. This activation stimulates gastrin secretion,[27] evokes dyspeptic symptoms (acutely, while if used chronically it reduces them) and affects gastric sensorimotor function.[28] At low dosages it stimulates the secretions of various gut peptides, in particular of calcitonin gene-related peptide (CGRP), which in turn stimulates microcirculation and protection of gastric mucosa from irritant compounds.[29]
The TRPA1 agonists cause 5-HT release in enterochromaffin cells and promote contraction of isolated strips of intestine via the 5-HT3 receptor. These results suggest that TRPA1 acts as a sensor molecule in enterochromaffin cells for the regulation of gastrointestinal functions. It stimulates vagal afferents and enteric nerves, which results in various gastrointestinal reactions, such as vomiting and peristaltic reflux.[30]
Allyl isothiocyanates, TRPA1 agonists, inhibit gastric ulcer formation in a similar but stronger fashion than the TRPV1 agonists (capsaicin and piperine) by modulating prostaglandin synthesis.[31]
Essential oils, and in general molecules capable of stimulating olfactory receptors, have been known for a long time to be able to produce physiological effects such as salivation, increasing appetite, etc. as part of the cephalic phase of motility and secretions of the gastrointestinal tract.[32]
It is therefore possible to envisage that a local stimulation of the tastant and olfactant receptors can act on afferent neurons (mainly of the vagus) with an effect on the CNS, on intrinsic efferent nerve fibers, with effect on the enteric nervous system, and on the rate of secretion of various peptides; which can then have effects on various systemic events, like mucosal proliferation, secretory processes, gastrointestinal motility, glucose homeostasis, etc.[33] This consequently affects functional disturbances of the gastrointestinal tract, like early satiety, sensation of fullness and meteorism, epigastric pain, abdominal cramps, nausea, motility disorders.
——————————————————————————————————————
[1] Kitamura, A., Torii, K., Uneyama, H., and Nijima, A. (2010) “Taste and health: Nutritional and physiological significance of taste substances in daily foods: Role played by afferent signals from olfactory, gustatory and gastrointestinal sensors in regulation of autonomic nerve activity”. Biol. Pharm. Bull, 33(11) 1778–1782; Dockray GJ. (2003) “Luminal sensing in the gut: an overview”. J Physiol Pharmacol.;54(Suppl 4):9–17; Rozengurt N, Wu S, Chen MC, et al. (2006) “Co-localization of the a-subunit of gustducin with PYY and GLP-1 in L cells of human colon”. Am J Physiol Gastrointest Liver Physiol.; 291:G792–G802
[2] Dockray 2003 Op. Cit.; Rozengurt. E. (2006) “Taste receptors in the gastrointestinal tract. I. Bitter taste receptors and alpha-gustducin in the mammalian gut”. Am J Physiol Gastrointest Liver Physiol; 291(2):G171-7
[3] Wu, S. V., Rozengurt, N., Moon Yang, Young, S.H., Sinnett-Smith, J., and Rozengurt, E. (2002) “Expression of bitter taste receptors of the T2R family in the gastrointestinal tract and enteroendocrine STC-1 cells”. PNAS, 99 (4):2392–2397
[4] Dockray 2003 Op. Cit.; Flemstrom, G. and Sjoblom, M. (2005) “Epithelial cells and their neighbors. II. New perspectives on efferent signaling between brain, neuroendocrine cells, and gut epithelial cells”. Am J Physiol Gastrointest Liver Physiol, 289: G377–G380
[5] Sternini, C. (2007) “Taste receptors in the gastrointestinal tract. IV. Functional implications of bitter taste receptors in gastrointestinal chemosensing”. Am J Physiol Gastrointest Liver Physiol, 292: G457–G461
[6] Nozawa, K., Kawabata-Shoda, E., Doihara, H., Kojima, R., Okada, H., Mochizuki, S., Sano, Y., Inamura, K., Matsushime, H., Koizumi, T., Yokoyama, T., and Ito, H. (2009) “TRPA1 regulates gastrointestinal motility through serotonin release from enterochromaffin cells” PNAS, 106(9):3408-3413
[7] Gollin L (2004) “Subtle and profound sensory attributes of medicinal plants among the Kenya Leppo`Ke of east Kalimatan, Borneo”. Journal of Ethnobiology, 24(2):173-201; Leonti M, Sticher O, Heinrich M (2002) “Medicinal plants of the Popoluca, México: organoleptic properties as indigenous selection criteria”. Journal of Ethnopharmacology, 81, 307-315; Pieroni A, Torry B (2007) “Does the taste matter?: taste and medicinal perceptions associated with five selected herbal drugs among three ethnic groups in West Yorkshire, Northern England”. Journal of Ethnobiology and Ethnomedicine, 3:21.
[8] Shepard GH (2004) “A sensory ecology of medicinal plant therapy in two Amazonian societies”. American Anthropologist, 106:2, 252-266.
[9] Scott K. (2005) “Taste recognition: food for thought”. Neuron, 48: 455– 464; Meyerhof, W., Behrens, M., Brockhoff, A., Bufe, B., & Kuhn, C. (2005) “Human bitter taste perception”. Chem senses; 30 Suppl 1(suppl 1), i14-5.
[10] Wu et al. 2002 Op. Cit.
[11] Behrens M, Meyerhof W (2010) “Oral and extraoral bitter taste receptors”. Results Probl Cell Differ.; 52:87-99
[12] Kidd, M., Modlin, I.M., Gustafsson, B.I., Drozdov, I., Hauso, O., and Pfragner, R. (2008) “Luminal regulation of normal and neoplastic human EC cell serotonin release is mediated by bile salts, amines, tastants, and olfactants”. Am J Physiol Gastrointest Liver Physiol, 295: 260 –272
[13] Meyerhof, Behrens, Brockhoff, Bufe, & Kuhn, 2005 Op. Cit.
[14] Meyerhof, Behrens, Brockhoff, Bufe, & Kuhn, 2005 Op. Cit.
[15] Wicks D, Wright J, Rayment P, Spiller R. (2005) “Anticipatory physiological regulation in feeding biology: Cephalic phase responses” Eur J Gastroenterol Hepatol., 17(9):961-5
[16] Powers MA, Schiffman SS, Lawson DC, Pappas TN, Taylor IL. (1990) “The effect of taste on gastric and pancreatic responses in dogs.” Physiol Behav; 47(6):1295-7.
[17] Rozengurt 2006 Op. Cit.
[18] Wicks D, Wright J, Rayment P, Spiller R. (2005) “Impact of bitter taste on gastric motility”. Eur J Gastroenterol Hepatol;17(9):961-5
[19] Sternini 2007, Op. Cit.
[20] Jeon, T.-I., Zhu, B., Larson, J.L., and Osborne, T.F. (2008) “SREBP-2 regulates gut peptide secretion through intestinal bitter taste receptor signaling in mice”. The Journal of Clinical Investigation; 118(11):3693-3700
[21] Dotson CD, Zhang L, Xu H, Shin Y-K, Vigues S, et al. (2008) “Bitter Taste Receptors Influence Glucose Homeostasis”. PLoS ONE, 3(12): e3974
[22] Salazar H, Llorente I, Jara-Oseguera A, García-Villegas R, Munari M, Gordon SE, Islas LD, Rosenbaum T. (2008) “A single N-terminal cysteine in TRPV1 determines activation by pungent compounds from onion and garlic”. Nat Neurosci;11(3):255-61
[23] Venkatachalam K, Montell C (2007) “TRP channels”. Annu. Rev. Biochem. 76: 387–417
[24] Behrendt HJ, Germann T, Gillen C, Hatt H, Jostock R. (2004) “Characterization of the mouse cold-menthol receptor TRPM8 and vanilloid receptor type-1 VR1 using a fluorometric imaging plate reader (FLIPR) assay”. Br. J. Pharmacol. 141 (4): 737–45
[25] Nilius B, Owsianik G, Voets T, Peters JA (2007) “Transient receptor potential cation channels in disease”. Physiol. Rev; 87 (1): 165–217
[26] Purhonen AK, Louhivuori LM, Kiehne K, Kerman KE, Herzig KH. (2008) “TRPA1 channel activation induces cholecystokinin release via extracellularcalcium”. FEBS Lett; 23;582(2):229-32
[27] Kidd M, Hauso Ø, Drozdov I, Gustafsson BI, Modlin IM. (2009) “Delineation of the chemomechanosensory regulation of gastrin secretion using pure rodent G cells”. Gastroenterology;137(1):231-41
[28] van Boxel OS, ter Linde JJ, Siersema PD, Smout AJ (2010) “Role of chemical stimulation of the duodenum in dyspeptic symptom generation”. Am J Gastroenterol;105(4):803-11.
[29] Abdel-Salam OM, Szolcsányi J, Mózsik G. (1997) “Capsaicin and the stomach. A review of experimental and clinical data”. J Physiol Paris; 91(3-5):151-71
[30] Nozawa, et al. 2009 Op. Cit.
[31] Matsuda H, Ochi M, Nagatomo A, Yoshikawa M. (2007) “Effects of allyl isothiocyanate from horseradish on several experimental gastric lesions in rats”. Eur J Pharmacol. 30;561(1-3):172-81
[32] Kitamura 2010 Op. Cit.
[33] Sternini, C. (2007) “Taste Receptors in the Gastrointestinal Tract. IV. Functional implications of bitter taste receptors in gastrointestinal chemosensing”. Am J Physiol Gastrointest Liver Physiol 292: G457–G461
La dose è tutto 3/3
Terzo (dopo il primo ed il secondo) problema: perché questi dosaggi?
Le posologie consigliate in molti testi di erboristeria e da molte aziende, e quindi usate da molti erboristi, sono spesso sotto il limite dell’efficacia, anche senza tenere in conto del sottodosaggio causato dall’utilizzo delle gocce come metodo di misurazione.
Per esemplificare la discrasia tra i dati tradizionali, sperimentali e clinici, e i dosaggi consigliati per le TM, vorrei brevemente mettere a confronto alcuni testi.
Per evitare da subito l’accusa di riduzionismo o di “farmacologismo”, userò come fonti attendibili sia i dati storici e etnobotanici, sia i dati clinici. Naturalmente non ambisco ad una analisi esaustiva e sistematica, e non mi nascondo i problemi relativi alla traduzione di dosaggi espressi in diverse forme galeniche. Purtuttavia, ritengo che alla fine della comparazione risalterà una differenza in dosaggi così evidente e di tale magnitudine che va ben oltre le variazioni dovute a questi problemi.
La comparazione
Per facilitare la comparazione, i vari dosaggi sono stati riportati in termini di grammi di droga secca: quindi un dosaggio giornaliero di 5-20 ml di tintura da pianta secca (1:5) è stato tradotto in un dosaggio giornaliero di 1-4 grammi di pianta secca. Questo tipo di calcolo non è naturalmente esatto né tiene conto delle differenti biodisponibilità delle diverse forme farmaceutiche, ma nonostante questa limitazione, ritengo che il calcolo rimanga comunque valido a grandi linee, e mostra chiaramente la differenza tra i dosaggi ricavati dai testi classici e farmacologici e quelli riportati da testi più recenti della scuola delle TM.
Ho qui riportato i dati dai testi del Dott. Brigo (“L’uomo, la fitoterapia, la gemmoterapia”) e della Dott.ssa Campanini (“Dizionario di fitoterapia e piante medicinali. II ed.”) semplicemente come esempio, in effetti dosaggi molto simili si trovano nel testo di Rossi sulle TM ed in genere in certa letteratura francese. A mò di contrasto sono stati inseriti i dosaggi indicati da Pedretti in un testo chiaramente non influenzato dalla scuola delle TM (“Chimica e farmacologia delle piante medicinali”). Altri testi di riferimento sono la British Herbal Pharmacopea (BHP), il PDR for Herbal Medicines (PDR), Herbal Medicines del 2007 (HM), le monografie WHO e quelle ESCOP. Per i dosaggi in medicina cinese (MTC) mi sono affidato al testo enciclopedico di Ou Ming, al testo di Song sui liquori medicati e al classico di Bensky e Gamble
Per la medicina del 19o secolo nordamericano (USA) mi sono basato sulla Materia Medica di Felter.
Tutti i dosaggi sono espressi in grammi di pianta secca.
|
Pianta |
TCM |
USA |
Pedretti |
Monografie |
Brigo |
Campanini |
|
Arctostaphylos uva ursi |
– |
1-4. |
2-8. |
PDR 12; HM 4.5-12; WHO 9-12 |
0.2-0.6 |
0,2-0,4 gr. |
|
Crataegus spp |
10-15 |
0,5-5 |
1-45 |
PDR 5; HM 0,64-6,3; WHO 3-6; ESCOP 2-5; BHP 1-3 |
– |
0,2-0,3 |
|
Echinacea spp |
– |
1-5,5 |
2-4 |
PDR 3-4,5; HM 1-3; WHO 3; BHP 3 |
– |
0,05-0,2 |
|
Ephedra sinica |
3-9 |
– |
3-5 |
HM (1,2-2,3); WHO 1999 (1-6); BHP 3-12 |
0,025-0,15 |
0,1-0,3 |
|
Ginkgo biloba |
3-6 |
– |
– |
PDR, HM, OMS, ESCOP (120-240 mg ES equivalente a ca. 4-16 grammi) |
– |
0,05-0,15 |
|
Glycyrrhiza spp. |
3-12 |
0,5-4,5 |
15-30 |
HM 3-12; WHO 5-15; BHP 2-3 |
0,1-0,2 |
0,17-0,42 |
|
Hydrastis canadesis |
– |
1-10 |
2-4,5 |
HM e WHO 1,5-3; BHP 1,5-3 |
– |
0,15-0,45 |
|
Panax ginseng |
5-10 decotto 1-2 polvere |
0,1-4,5 |
0,5-2 |
PDR 1-2; HM 0,5-1; WHO 0,5-2; BHP 3-6 |
0,3 |
– |
|
Passiflora incarnata |
– |
2-11 |
1 |
HM 1,5-8 polvere, 7,5-10 grammi in infuso; BHP 0,8-3 |
0,2-0,7 |
0,2-0,4 |
|
Rheum palmatum |
3-6 |
0,3-2 |
1-4 |
PDR 2,3-4,5; WHO 0,5-1,5 |
– |
0,1-0,4 |
|
Serenoa serrulata |
– |
2,7-10,8 |
– |
PDR 1-2; HM 1,5-3; WHO 1-2; BHP 1,5-3 |
0,05-0,1 |
– |
|
Silybum marianum |
– |
– |
10-12 |
PDR, HM, WHO 12-15; BHP 10-12 |
0,2-0,6 |
0,15-0,4 |
|
Taraxacum officinale |
9-30 |
8 |
1-5 |
HM 6-24; WHO 9-12; BHP 1-5 |
0,1-0,6 |
0,2-0,5 |
|
Valeriana officinalis |
– |
2,1-6 |
1-4 |
PDR 15; HM 3-9; WHO 2-15; BHP 1-4 |
0,2-0,3 |
|
|
Zingiber officinale |
3-9 |
0,5-1,5 |
– |
PDR 2-4; HM 0,75-3; WHO 1-4 |
– |
0.15-0,35 |
Valutazione
Nonostante questa analisi sia non sistematica e problematica a causa della traduzione imperfetta tra varie forme farmaceutiche, credo salti subito all’occhio come i dosaggi proposti dai due testi della Campanini e di Brigo siano sempre di molto inferiori ai dosaggi proposti negli altri testi, di fatto da 10 a 20 volte inferiori ai dosaggi considerati terapeutici.
Anche tendendo in considerazione le differenze dovute alle forme farmaceutiche e alle diverse biodisponibilità, i valori rimangono molto al di sotto del range efficace.
Questo dato è ancora più sorprendente se si valuta il fatto che il testo della Campanini presenta una buona analisi dei dati relativi alle piante ed ai dosaggi efficaci. Ovvero, l’utilizzo di dosi di TM così inferiori al minimo efficace non può essere fatto risalire ad una mancata o deficitaria analisi dei dati. Oltretutto questa discrasia risulta ancora più inspiegabile se si comparano i dosaggi dati in termini di altre forme galeniche (estratto fluidi, estratti secchi, ecc.) che sono di norma in linea con le valutazioni della stessa autrice nelle sezioni di farmacologia, e con i dosaggi presenti negli altri testi da me analizzati.
Come accennavo precedentemente, è come se gli autori considerassero la TM una forma galenica estremamente potente, molto di più degli estratti secchi, ad esempio, senza però portare alcuna giustificazione per questa sorprendente posizione. Ritengo che questo non sia che una rimanenza di un approccio omeopatico alla fitoterapia. Nulla ho da dire rispetto alla teoria e alla prassi dell’omeopatia, al fatto che vi sia totale consistenza interna nell’utilizzo di questi dosaggi di TM in ambito omeopatico, ma certamente questi non dovrebbero avere spazio nella fitoterapia.
Conclusioni
Da quanto visto è chiaro che per raggiungere una dose terapeutica sono necessari dosaggi ben più elevati di quelli generalmente consigliati, e che questi dosaggi sono difficilmente raggiungibili con tinture madri a titolo 1:10, sia per ragioni pratiche (sarebbe necessario consumare dai 20 ai 100 ml di tintura al giorno) che per ragioni economiche, e quindi per ragioni di compliance del paziente.
Come da molti anni vado ripetendo, ritengo che le TM siano delle preparazioni del tutto inadeguate per la fitoterapia, non necessarie, costose, sempre a rischio di sottodosaggio, e quindi sempre a rischio di svalutare agli occhi del pubblico la reale efficacia e razionalità della fitoterapia.
La dose è tutto 2/3
Analizzato nel post precedente il problema delle TM vs. altri estratti idroalcolici, veniamo al secondo problema: le gocce.
Secondo problema: perché le gocce?
L’utilizzo delle gocce come unità di misura delle forme liquide potrebbe sembrare solo un dettaglio tecnico ma non è meno importante della forma galenica scelta. Nonostante questo metodo di misura possa teoricamente avere ancora una giustificazione quando si trattasse di dispensare estratti liquidi di piante estremamente potenti (Phytolacca, Atropa, Datura, Convallaria, ecc.), quando si tratti di piante in libera circolazione e non tossiche, esso è da considerarsi arcaico e poco razionale, per il semplice fatto che non da garanzia di uniformità.
Questo fatto dovrebbe essere evidente se consideriamo che non esiste un rapporto preciso che correli le gocce al volume del liquido, poiché questo rapporto dipende dal tenore alcolico, e quindi dalla sua viscosità.
In un esperimento eseguito da Bone nel 2005 sono state messi a confronto 4 diversi tipi di estratti liquido misurati con due tipi di contagocce, a foro ampio e a foro ridotto, per vedere il numero di gocce necessario per raggiungere 1 mL.
Il risultato è sorprendete se lo compariamo alla vulgata che vuole che per ogni mL ci vogliano 20-25 gocce. Si osserva un aumento del numero di gocce necessario per arrivare al mL all’aumentare del tasso etanolico.
- Un glicerinato 1:1 di cardo mariano al 5% di etanolo vuole dalle 28 alle 33 gocce (a seconda del diametro del’orifizio) per fare 1 mL.
- Un estratto 1:2 di arpagofito al 25% di etanolo ne vuole 39-44
- Un estratto 1:2 al 45% di etanolo di peonia bianca da 45 a 50 gocce
- Un estratto di semi di sedano 1:2 al 60% di etanolo da 50 a 60
- Un estratto 1:5 al 90% di etanolo di mirra ne vuole da 50 a 65.
Come si può notare, anche facendo una valutazione conservativa di 40 gocce per mL in media, siamo quasi al doppio del dosaggio “standard”, ovvero rischiamo di dosare sempre la metà della quantità efficace, con evidenti riflessi sull’efficacia della terapia! Anche una pianta medicinale di sicura efficacia non può essere sfruttata a dovere se usata al di sotto del dosaggio efficace.
Bologna…
Scrapbook?
A quanto pare, sono classificabile come un barbagianni 1.0 e il mio blog merita un alleggerimento (ma come, non bastava questo?).
Ma grazie al punto 5, eccomi qui all’outing 🙂

1. Sono molto permaloso, timido, ma alla mattina faccio il caffè a qualsiasi ora
2. Soffrivo di deficienza di sense of humor, parzialmente corretta da una buona dose di british sarcasm e dal successivo addestramento pluriennale da parte di B.A.B.I. Rimango più divertente quando parlo in inglese…
3. Sono stato studente forestale, abbandonando miseramente la tenzone, poi massaggiatore a domicilio, barista a Reading, insegnante di chimica a Londra, masseur and herbalist a Edmonton, blah blah blah. Poi sono tornato in Italia…
4. Mai stato un atleta, l’unica attività fisica che mi sia mai piaciuta più di leggere è stato l’arrampicata (beh, anche la bici e camminare, ma non mi parevano attività abbastanza sportive…). Lo confesso, anche in questo campo ho gusti un pò british e il serpente nero del Peak District , il gritstone e la loro etica intransigente di mi attraggono più della dolomia. Nel 1989 ho passato 3 mesi in Yosemite che ormai fanno parte del mio nostalgico repertoire.
5. Vado dalla strizza per poter fare Scrapbook outing senza problemi (vedi che funziona!?)
6. Cose…: La pragmatica della comunicazione umana e Verso una ecologia della mente, anni fa; Proust 1990-1992; Londra 1993; Padova 1995; Nicaragua e Los Quinchos 2002; Elaine Scarry The Body in Pain; Kleinmann; Pavese; Radio tre; Radio Four; Kurt Goldstein, ecc.
7. Non mangio carne da…21 anni
8. Sono sempre riuscito ad evitare di diventare un esperto in qualche cosa. L’unica professione che mi ero conquistata, clinical herbalist, l’ho bruciata tornando in Italia, vorrà dire qualcosa? Rimango un amateur che ruba il lavoro ai veri esperti 🙂
9.Mi piace un casino fare il pane e mangiarlo
10. Mi piace GiPi, ma anche il primo Hellblazer, anni 80, punk anti-thatcherite