Dopo un imperdonabile iato concludo la prima tranche di elucubrazioni uomo-piantesche. Potete recuperare le puntate precedenti qui, qui, qui, qui, qui, e qui.
Per approfondimenti correlati ma tangenziali consiglio i sempre ottimi post di Meristemi (aka Erba Volant) qui, qui e qui.
Alcuni testi sono stati importanti per la scrittura di questo post, e più in generale per immaginare la serie stessa: questo, questo, questo, questo e questo.
——————————————————————————————
Riprendendo le fila del discorso, nella puntata incentrata sul rapporto chemioecologico e coevolutivo tra uomo e piante avevo citato vari autori (ma ho fatto e farò principalmente riferimento a Johns)[1] secondo i quali l’individuazione da parte dell’uomo di alcune piante “specificamente” medicinali fosse da far derivare dalla combinazione di vari fattori, quali:
- lo sviluppo di meccanismi biologici, comportamentali e tecnologici di gestione del contatto con le piante e con i compostiin esse contenuti (fuoco, meccanismi di detossificazione);
- la possibilità, resa concreta da tali meccanismi, di avvantaggiarsi delle proprietà tossiche delle piante in senso farmacologico;
- l’avvento della tecnologia e dell’agricoltura che, modificando gradualmente ma drasticamente, la dieta umana, resero possibile l’assunzione di maggiori quantità di proteine (derivate da piante coltivate e carne di allevamento) e di minori quantità di piante tossiche nell’alimentazione;
- il paradossale aumento della varietà di specie vegetali non coltivate (e del lessico ad esse associato) disponibili ed utilizzate dalle popolazioni di orticultori rispetto a quelle dei cacciatori-raccoglitori (il c.d. paradosso botanico-dietetico, vedi sotto).
Secondo Johns è grazie a questi fattori che l’uomo ha potuto nutrirsi con meno rischi (sviluppando meccanismi biologici e tecniche di detossificazione, e poi selezionando piante meno ricche in metaboliti secondari) ed ha potuto iniziare a isolare le piante più ricche in composti farmacologicamente attivi da quelle coltivate a scopo alimentare, quindi a distinguere il campo “terapeutico” da quello nutrizionale,[2] permettendo l’isolamento di una nuova categoria, addirittura di un nuovo oggetto: le piante “medicinali”.[3]
Quindi la medicina, intesa come pratica culturale che comprende l’utilizzo intenzionale di sostanze farmacologicamente attive, affonderebbe le sue radici in un dato biologico evoluzionistico (che fissa diciamo le condizioni di esistenza della medicina) ma nasce nel momento in cui diviene possibile isolare esplicitamente degli elementi (e quindi degli operatori) come terapeutici.
Sembra quindi che il passaggio all’agricoltura, a cui ho accennato in questa precedente puntata, oltre ad essere stato rivoluzionario dal punto di vista alimentare, sociale e culturale, abbia giocato un ruolo cardine anche nello sviluppo della medicina. Vorrei quindi soffermarmi in questa puntata proprio sui dettagli di questo passaggio, riprendendo ed approfondendo alcuni degli argomenti affrontati nei post sulla fitoalimurgia Chepang (qui e qui).
Le conseguenze del passaggio all’agricoltura: medicine alimentari e alimenti medicinali
Il graduale passaggio dalla caccia-raccolta all’agricoltura costituisce uno snodo cruciale che ha influenzato i successivi fenomeni di utilizzo delle piante. Ha influenzato sia le competenze dei gruppi umani rispetto alle piante medicinali, sia le loro competenze alimentari, e quindi la loro possibilità di curarsi e nutrirsi.
I dati etnobotanici si possono spesso analizzare secondo due assi; uno è quello che unisce piante alimentari e piante medicinali (l’asse piante alimentari-medicinali, o asse AM) e l’altro è quello che unisce piante selvatiche e piante coltivate (l’asse piante selvatiche-coltivate, o asse SC). I punti di contatto e di sovrapposizione tra questi assi, punti di contatto e relazioni spesso complesse e soggette a fenomeni di coevoluzione biologica e culturale, sono importanti per comprendere in che modo le competenze degli uomini siano state influenzate dal passaggio all’agricoltura.
Questo tipo di analisi è complesso. La distanza temporale che ci separa dall’oggetto di studio non permette di testare direttamente le ipotesi presentate, né di sapere direttamente quale fosse il rapporto tra le popolazioni preistoriche e il mondo vegetale. Inoltre, come è già stato sottolineato, il passaggio da un tipo di rapporto alimentare ad un altro non ha seguito una traiettoria inevitabile, lineare, unidirezionale, intenzionale: “e certamente non un allontanamento “naturale” e inevitabile” dalla caccia e raccolta.[4] Lungo l’asse raccolta-agricoltura sono state possibili tutte le permutazioni, alcune di esse ancora visibili al giorno d’oggi”: caccia e raccolta, orticoltura (coltivazioni estensive, a bassa tecnologia, con orti familiari a multicoltura), debbio, agricoltura (coltivazione intensiva, ad elevata tecnologia e a monocoltura) ed agricoltura industriale.[5]
La letteratura etnobotanica ci può aiutare offrendo all’analisi le conoscenze e le competenze che caratterizzano e distinguono il rapporto con le piante proprio dei cacciatori-raccoglitori da quello degli agricoltori[6]; ci offre quindi uno strumento essenziale per avanzare delle ipotesi su come sia cambiato il rapporto con il mondo vegetale durante il neolitico, su come le conoscenze e le competenze rispetto alle piante siano cresciute e cambiate, e su come tutto questo abbia a che fare con la nascita della medicina.
Per meglio valutare il significato dei dati etnobotanici è però necessario soffermarsi sulla terminologia che utilizzeremo, e sui problemi che derivano dalla necessità di semplificare la complessità. Negli studi quantitativi in antropologia è necessario, infatti, utilizzare categorie specifiche, appunto per permettere uno studio analitico. Questa necessità si scontra però con problemi definitori e di demarcazione, in particolare su due assi, quello del continuum tra piante alimentari e piante medicinali (asse AM), e quello del continuum tra piante selvatiche e piante coltivate (asse SC).[7]
L’asse AM
Anche se è sempre possibile identificare degli esemplari delle due categorie che non lasciano spazio all’ambiguità (ad esempio grano come alimento e Atropa belladonna come medicina), i confini tra piante alimentari e medicinali non sono sempre così netti. Alcuni autori sostengono, infatti, che questa distinzione è in realtà largamente assente nelle popolazioni indigene o è comunque fortemente dipendente dal contesto.
E’ necessario quindi introdurre nuove definizioni che descrivano senza semplificare eccessivamente il continuum alimentare-medicinale. Pieroni e Quave propongono tre categorie:[8]
- Piante usate sia come medicine sia come cibo, ma senza alcuna correlazione tra i due usi.
- Piante che a parte gli scopi alimentari o edonistici hanno anche altri effetti sul corpo (depurativi, alterativi, tonici del sangue, antiossidanti, ecc.): definiti come cibi funzionali.
- Piante che vengono consumate chiaramente come alimento ma per ottenere effetti specificamente terapeutici: definiti come cibi medicinali o medicine alimentari.
L’asse SC.
Altrettanto complessa è la categorizzazione delle piante in base al loro rapporto con l’uomo in termini di gestione. Anche in questo caso i poli estremi sono facilmente identificabili (piante selvatiche e piante addomesticate e coltivate) ma il territorio intermedio presenta molte sfumature e sovrapposizioni. Ad esempio, ci dice la Price, le piante eduli semi-selvatiche, o selvatiche ma gestite e non addomesticate, sono una caratteristica primaria dei sistemi agricoli. Allo stesso tempo sono differenti dalle piante selvatiche dei cacciatori-raccoglitori, perché provengono molto spesso da aree di successione, ruderali, bordi stradali, ecc., piuttosto che dalla foresta.
Vari autori propongono un elenco di categorie basato sulle differenti pratiche agricole e sulla selezione che operano sulle piante:[9]
- Piante addomesticate: geneticamente modificate e completamente dipendenti dall’uomo.
- Piante semiaddomesticate: parzialmente modificate e non compeltamente dipendenti dall’uomo.
- Piante coltivate: introdotte in sistemi agronomici e mantenute in letti di coltivazione.
- Piantegestite: protette grazie all’attività umana e aiutate nella competizione con le altre piante.
- Piante selvatiche in senso stretto: usate ma non coltivate né gestite.
Nota Bene: le piante di cui ai punti 2, 4 e 5 possono essere definite come piante selvatiche in senso lato.
Per portare un esempio calato nella realtà, Hanazaki e collaboratori, in uno studio sulle piante alimentari e medicinali in Amazzonia, distinguono 4 tipi di rapporto con le piante:[10]
- Piante con nessuna o ridotta gestione umana, tutte native, raccolte nella foresta, e che costituiscono il 26% delle piante totali utilizzate.
- Piante facilitate dalla gestione umana, native all’80%, raccolte in molti ambienti diversi, nella foresta, nelle coltivazioni a debbio, nelle zone ruderali e nelle vicinanze delle case. Costituiscono il 12% delle piante totali utilizzate.
- Piante coltivate ma raramente, native solo al 20%, raccolte in molti ambienti diversi ma non nella foresta: coltivazioni a debbio, nelle zone ruderali, nelle vicinanze delle case e negli orti. Costituiscono la maggior parte (56%) delle piante utilizzate.
- Piante coltivate. Native solo al 20%, raccolte nelle zone di coltivazione a debbio. Costituiscono solo il 6% delle piante totali utilizzate.[11]
La formazione del sapere relativo alle piante nel passaggio all’agricoltura
Logan e Dixon, cercando di dare risposta a questa domanda, propongono che le popolazioni indigene di cacciatori-agricoltori utilizzino una percentuale limitata dei taxa disponibili, scelta tramite un processo non casuale di selezione basato su caratteristiche poco usuali che permettono di distinguere facilmente alcune piante da altre. Operando questa forte selezione, tralasciando moltissime piante e concentrandosi solo su poche specie “interessanti”, da investigare, l’uomo “trasforma un problema intrattabile in un dominio di indagine gestibile”.[12]
Nancy Turner identifica alcune caratteristiche che definiscono la “salienza percettiva”, l’ ”ovvietà”, delle piante “interessanti”:[13]
- Essere ubiquitarie
- Morfologia, colori, aromi, sapori rari o facilmente individuabili
- La capacità di causare forti reazioni (ad esempio dermatite da contatto)
- L’essere libere da infestazioni
- Il fatto che altri animali se ne cibino,
- Il possedere caratteristiche antropomorfe
Una volta individuate, queste caratteristiche servono come strumenti euristici per categorizzare altre piante, all’interno di una tassonomia locale trasversale alla tassonomia scientifica. Ad esempio, le piante allucinogene del genere Datura [Solanaceae] sono amare, piccanti e nauseanti, e queste caratteristiche sono state utilizzate dalle popolazioni indigene per predire proprietà allucinogene in altre specie che possedevano le stesse caratteristiche.
Le conoscenze e le tassonomie popolari sono molto più sensibili al contesto e meno generalizzabili delle tassonomie scientifiche, per cui è del tutto probabile che questi processi di acquisizione del sapere e di generalizzazione abbiano portato ad incidenti (intossicazioni o avvelenamenti), ad esempio quando spostandosi da aree conosciute a nuovi territori, con nicchie ecologiche diverse, i raccoglitori utilizzano piante che paiono sovrapponibili a quelle conosciute ma ne differiscono, a volte con risvolti tossici.[14]
Un’occhiata ai dati
Louis Grivetti, uno degli autori che più hanno contribuito a definire il campo della ricerca tra cibo e medicina, riporta i risultati di uno studio effettuato nel 1973 in Botswana, nel deserto del Kalahari, tra i popoli Tswana, ed in particolare con i baTlokwa.[15]
I baTlokwa sono coltivatori con una vasta conoscenza delle piante selvatiche commestibili (Grivetti registra più di duecento specie conosciute),[16] che servono a sostenere l’alimentazione della popolazione in tempi di scarsità, quando le cultivar alimentari tipiche scompaiono per la siccità o per una stagione particolarmente povera.
Alcune di queste piante sono semplici cibi spontanei, altre sono dei cibi-medicina, altre ancora sono delle piante consumate come cibo solo in situazioni di emergenza alimentare, i cosiddetti cibi da carestia (ad esempio i frutti ed I semi di “magabalka” [Cucumis myriocarpus Naudin — Cucurbitaceae], solitamente usati come foraggio, o le foglie di “moologa” [Croton gratissimus Burch. — Euphorbiaceae], normalmente usata come pianta magica, o la radice di “motlopi” [Boscia albitrunca (Burch.) Gilg & Benedict — Capparaceae o Brassicaceae], usata al posto del sorgo [Sorghum arundinaceum (Desv.) Stapf — Graminae].
Che le piante selvatiche svolgano un ruolo importante per il sostentamento della popolazione è sottolineato, secondo l’autore, dal diverso destino delle popolazioni del Kalahari orientale e del Sahel:
“(p)er più di cento anni i baTlokwa del deserto del Kalahari orientale, nel Botswana, non hanno sofferto di carestie o di ripercussioni a livello sociale a causa della siccità. Tale successo alimentare in quest’area è dovuto all’equilibrio tra offerta ambientale e decisioni culturali. Il Kalahari orientale offriva una elevata diversità di piante selvatiche eduli, ed i baTlokwa utilizzavano regolarmente tali risorse. Il messaggio più importante che emerse dopo due anni di lavoro sul campo fu che la siccità non aveva causato carestie, e che una spiegazione per il disastro del Sahel [ovvero la tremenda carestia che colpì la regione del Sahel a seguito di una lunga siccità, proprio negli anni della ricerca nel Kalahari. NdT] era l’incapacità culturale a riconoscere ed utilizzare le risorse alimentari selvatiche disponibili — cibi che in precedenza erano stati utilizzati come sostentamento durante le siccità“.[17]
In una ricerca basata nello Swaziland gli autori notano che il 40% degli informatori usa il 50% e più di piante selvatiche per l’alimentazione, raccolte nei campi coltivati o gestite negli orti casalinghi. Gli autori scoprono altresì che i bambini mostrano maggiori competenze rispetto agli anziani, al contrario di ciò che Grivetti aveva notato nel Kalahari, e propongono che ciò sia dovuto al fatto che I bambini devono attraversare varie zone ecologiche diverse per andare a scuola, e sono quindi esposti ad una maggior diversità vegetale.[18] In Nigeria, tra gli Hausa, il 93% della popolazione gestisce e protegge le piante infestanti, ed il 50% del cibo vegetale viene raccolto nel selvatico (nello specifico 39 specie raccolte negli orti familiari, 6 specie raccolte lungo i bordi dei campi e dei sentieri, e 16 specie raccolte nei terreni a gestione comunitaria).[19] Nel Burkina Faso Smith e collaboratori riportano che il 36% dei vegetali consumati nei villaggi (ed il 20% di tutti gli alimenti) sono selvatici.[20] Vainio-Mattila osserva che tra i Sambara in Tanzania i vegetali consumati includono 73 specie di piante selvatiche, ruderali o infestanti.[21]
In Kazakistan il 25% delle famiglie raccoglie piante selvatiche (bacche, bulbi, frutta, piante medicinali e funghi).[22]
Secondo la Price in Tailandia, nei terreni coltivati a riso (ed intorno ad essi), si riconoscono e raccolgono 77 specie di piante selvatiche.[23] Inoltre quasi il 90% delle famiglie gestisce piante non domesticate negli orti familiari.
La raccolta delle piante è demandata quasi totalmente alle donne, per le quali questa attività è secondaria ad altre. Dato infatti che le donne svolgono molte attività legate alla casa, alla famiglia, al gruppo sociale, e sono per questa ragione costrette a muoversi sul territorio e a trapassare molti confini ecologici, esse entrano in contatto con molte specie diverse di piante (in maniera simile a quanto visto per i bambini nello Swaziland) che vengono raccolte “sulla via per” fare qualcosa d’altro.[24]
Nel Nepal centrale, nella comunità Chepang della zona di Shaktikhor, sul massiccio del Mahabarath, la maggior parte dei nuclei familiari (ca. il 90%) usa le risorse forestali o non coltivate a scopo medicinale, per venderle al mercato, o per sopperire ad una vera e propria mancanza di cibo (il 75% dei nuclei familiari), e gestisce in qualche modo le piante selvatiche, sia attraverso una protezione in situ, sia attraverso processi preagricoli di domesticazione. Tutte le famiglie stoccano, oltre ai cereali coltivati, piante selvatiche, in particolare Githa (Dioscorea bulbifera L. — Dioscoreaceae) e Bhyakur (Dioscorea deltoidea Wall. ex Griseb.) e in minor misura dei germogli di bambù (Bambusa nepalensis Stapleton – Poaceae).
In generale le donne Chepang sono leggermente più competenti degli uomini rispetto alle piante selvatiche, ma la differenza non è molto significativa. E’ possibile che le ridotte competenze agricole dei Chepang possano in parte spiegare questa uniformità tra uomini e donne: non avendo sviluppato molto la coltivazione degli orti familiari, forse è venuta a mancare alle donne Chepang la possibilità di aumentare le loro competenze sulle piante degli ambienti di transizione.[25]
In uno studio sulla zona amazzonica Hanazaka e collaboratori sottolineano come la foresta contribuisca solo al 28% per le specie selvatiche consumate, mentre le zone ruderali e I terreni intorno alle case contribuiscono per il 52%, e gli orti e le coltivazioni a debbio per il 20%.[26] In maniera simile Dufour e Wilson notano che il 41% delle piante eduli amazzoniche sono alberi, di cui il 50% proviene dalla coltivazione a debbio.[27] Emerge quindi l’importanza delle zone a vegetazione successionale, a crescita secondaria.[28]
A Cuba su circa 260 specie di piante medicinali e alimentari, solo 25 sono delle cultigen. Tra le non-cultigen, 82 (di cui 39 cibi-medicina) provengono da raccolta in area agricola, 36 (di cui 6 cibi-medicina) dai bordi dei campi, e 56 (di cui 16 cibi-medicina) dalle terre a gestione comunitarie.[29] La ricerca di Vandebroek e Sanca sulle Ande boliviane ha riscontrato che il 58% delle specie medicinali-alimentari è selvatica, e che le famiglie con la miglior sovapposizione tra uso medicinale ed alimentare sono Lamiaceae, Fabaceae, Asteraceae, e Solanaceae.[30]
Nello studio di Ana Ladio sull’utilizzo delle piante selvatiche in una comunità Mapuche della Patagonia nordoccidentale si evidenzia che:
- Le piante medicinali-alimentari sono raccolte più vicino agli insediamenti
- Viene dedicato meno tempo alla raccolta delle piante medicinali-alimentari rispetto a quelle alimentari
- Vengono raccolte quantità minori di piante medicinali-alimentari rispetto a quelle alimentari.[31]
La stessa autrice nota una buona sovrapposizione tra piante alimentari e piante medicinali, e delle chiare differenze chemiotassonomiche tra piante medicinali-alimentari (evolutivamente più recenti) e piante esclusivamente alimentari (evolutivamente più antiche).[32]
Proprio quest’ultimo dato pare particolarmente interessante. Ritornando a quanto accennato nel capitolo sull’evoluzione dei sistemi di difesa chimici delle piante, il rapporto tra la percentuale di piante medicinali presenti in una famiglia botanica ed il livello evolutivo della famiglia stessa sembra coerente con quanto sappiamo sull’evoluzione.
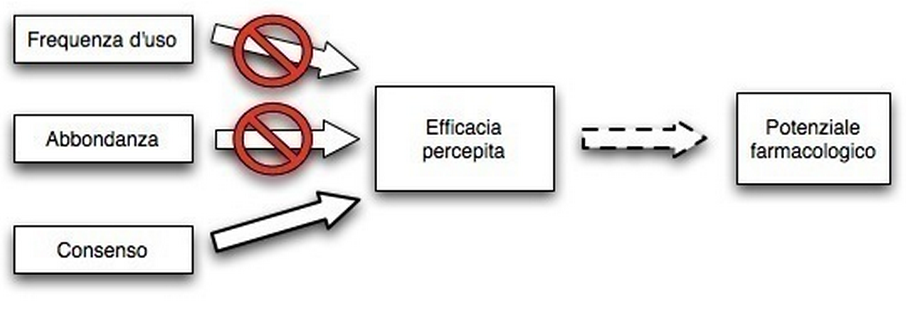
Prendendo per buona questa ipotesi, il riconoscimento da parte dell’uomo di questo trend dovrebbe avere un effetto sull’evoluzione antropogenica, nel senso che la selezione da parte delle popolazioni umane delle piante “utili” tenderebbe a far risaltare maggiormente questa distinzione.
Ad esempio: “nella discussione sull’addomesticamento è di fondamentale importanza includere (nell’analisi NdT) piante con potenziale farmacologico (e non solo quelle a contenuto calorico NdT) in modo da comprendere realmente il continuum delle relazioni uomo-pianta”.[33] Nel calcolo costi/benefici della raccolta piuttosto che della coltivazione è riduttivo quindi utilizzare nell’equazione solo importi calorici senza tenere presente fattori extranutrizionali. E’ probabile che le scelte effettuate dai raccoglitori dipenderenno dalla massimizzazione delle calorie e dalla minimizzazione delle spese energetiche, ma anche dalla necessità di minimizzare gli antinutrienti e di massimizzare gli xenobiotici vantaggiosi.
Questa riflessione dovrebbe ricordarci che i processi di addomesticazione sono di natura evolutiva e mostrano molti stadi e condizioni intermedie lungo un gradiente, lungo il quale “ gli esseri umani alterano la struttura genetica delle popolazioni di piante utili, modificano la loro distribuzione ed abbondanza attraverso la gestione non agricola.[34] Questo significa che le popolazioni non modificano solo il paesaggio tramite la coltivazione ma modificano anche l’ambiente dove vivono e vengono raccote le piante spontanee gestite con modalità ‘preagricole’. In ogni momento dato l’interazione uomo-pianta è il risultato di un graduale processo di aumento dell’intensità della gestione delle piante e dell’ambiente”.[35]
Il paradosso botanico-dietetico
Nonostante comunemente si ritenga che la foresta contenga un tesoro nascosto di piante medicinali, è probabile che la maggior parte di quelle usate dai cacciatori-raccoglitori venga (ora come un tempo) dalla prateria e dai bordi forestali, e che siano le piante infestanti o ruderali a giocare il ruolo più importante.
A questa conclusione arrivano molti autori sia dopo una analisi approfondita dei testi di etnobotanica che riportano la provenienza delle piante medicinali.[36] Sia a seguito di pubblicazioni specifiche sul rapporto tra piante medicinali e infestanti. Hanazaki e collaboratori hanno ad esempio evidenziato nel loro studio sull’utilizzo delle piante alimentari e medicinali in Amazzonia, come la foresta contribuisca al 28% delle specie utilizzate, le zone ruderali e i dintorni delle case al 52%, gli orti e le coltivazioni a debbio al 20%.[37] In un altro articolo sulle piante medicinali utilizzate dai nativi americani gli autori mostrano come esista una forte preferenza per le piante infestanti: in Nord America, le infestanti rappresentano solo il 9.6% della flora, ma il 26% della flora medicinale, e in Chiapas le infestanti sono il 13% della flora ed il 34% della flora medicinale.[38]
Sette delle dodici famiglie di invasive più importanti sono famiglie molto importanti come medicinali: Asteraceae, Fabaceae, Convolvulaceae, Euphorbiaceae, Chenopodiaceae, Malvacae, e Solanaceae.[39]
Una analisi del lessico relativo al mondo vegetale rivela inoltre che spesso le società orticulturali hanno una folk taxonomy e un ventaglio di termini (su piante medicinali e malattie) in media più ricco dei cacciatori raccoglitori puri.[40] Sembrerebbe quindi, dice la Price, che l’allontanarsi dalla dipendenza totale dalla foresta come fonte di cibo comporti un aumento, e non una diminuzione, della diversità di piante consumate, che l’avvento dell’agricoltura abbia comportato certamente una perdita in biodiversità selvatica (tanto maggiore quanto più intensa/iva l’agricoltura), ma che paradossalmente in certi casi abbia aumentato la biodiversità alimentare, delle piante da carestia e delle piante cibo-medicina.[41]
Le ragioni di questo paradosso sono varie, ed includono:
1. Gli ambienti agricoli ed orticulturali hanno biodiversità comparabile o più elevata a quella della foresta.[42] L’impatto degli insediamenti umani e dell’agricoltura sul territorio avrebbe creato zone periagricole, zone di confine tra foresta e coltivazioni, e ambienti disturbati dall’attività umana, come campi, bordi, sentieri, ecc. che offrono un habitat importante per molte specie colonizzatrici, infestanti e ruderali. Questo processo avrebbe aumentato il numero di specie presenti e facilmente osservabili. Alcune di queste piante vennero addomesticate o rimasero comunque all’interno del continuum tra piante alimentari e medicinali, rivestendo ora un ruolo ora l’altro a seconda delle condizioni contingenti, andando ad arricchire il lessico delle popolazioni locali. Come ha rilevato la Price spesso la maggior diversità di piante utilizzate dipende dal fatto che le donne, per il ruolo da esse svolto nelle società tradizionali, si occupano della casa e del giardino e quindi sono in diretto contatto con tutte le aree transizionali tra foresta e coltivazioni.[43]
2. Le infestanti sono nella maggior parte dei casi piante a rapida crescita, opportunistiche, colonizzano rapidamente un’area e rapidamente muoiono. Per questa ragione esse si basano per la loro difesa sulla produzione di composti chimici qualitativi (metaboliti molto attivi e tossici come alcaloidi, terpeni, glicosidi cardiaci, ecc.) piuttosto che composti quantitativi (tannini e lignine, antinutrizionali ma non tossici), più tipici nelle piante perenni non successionali (piante da climax).[44]
3. La dieta agricola si era fortemente semplificata, passando dalle decine di piante usate come alimento dai cacciatori-raccoglitori a solo due-tre piante (a volte addirittura solo una, come nel caso del mais [Zea mays L. — Graminae] in Mesoamerica) alla base dell’alimentazione degli agricoltori.[45] Questa semplificazione portò probabilmente al desiderio di usare le piante aromatiche e resinose nella preparazione degli alimenti, per diversificare I sapori, e questo a sua volta portò ad una maggior complessità del lessico legato a sapori ed odori.
4. La conoscenza delle piante spontanee, da carestia, ecc. Funzionava da meccanismo di sicurezza in caso le coltivazioni non riuscissero a sostenere la popolazione.[46]
Conclusioni
Che conclusioni si possono trarre dai dati appena esposti?
Il concetto che la nascita dell’agricoltura e la natura ambigua delle infestanti (al limine tra alimenti o medicine) abbiano influenzato il crescere della conoscenza sulle piante sembra supportato dai dati, e permette ad alcuni autori di formulare nuove ipotesi sulla nascita di questa conoscenza, differenti da quelle unilineari che fanno dipendere la “scoperta” delle piante medicinali dal loro utilizzo come cibo. Etkin e Ross propongono ad esempio, sulla base del loro studio sulla dieta degli Hausa in Nigeria, che le piante possano essere prima identificate come portatrici di “salienza percettiva”, vengano quindi manipolate ed entrino nel continuum tra spontaneo e coltivato, vengano usate come medicine e successivamente, sotto la pressione delle emergenze, diventino anche “cibi selvatici” o “da carestia”; successive manipolazioni possono poi spostare le specie più adatte verso la domesticazione ed il passaggio a pianta decisamene alimentare.[47]
Da questa prospettiva risulta allora più chiaro il perché, ad esempio, la maggior parte delle piante con azione sulla fertilità e riproduzione umane in varie parti del mondo siano delle piante invasive, coltivate o addomesticate, ed anche perché siano spesso usate come spezie: peperoncino, menta spicata, cipolla, aglio, chiodi di garofano, noce moscata, cumino, pepe, avocado, ananas, papaia, puleggio, sesamo, agrumi.[48]
Certamente che non è possibile tracciare dei percorsi lineari nel rapporto uomo-piante. Percorrendo lo spettro tra caccia e raccolta ed agricoltura spinta, ciò che colpisce è che seppure la dieta e le competenze naturali degli agricoltori intensivi siano certamente di inferiore qualità rispetto a quella dei cacciatori-raccoglitori, in alcuni degli stadi di passaggio tra i due poli le competenze sono aumentate, e non diminuite, e probabilmente anche la dieta, fino a quando le piante selvatiche ricche in composti farmacologicamente attivi sono rimaste parte integrante della dieta, seppure iniziando a distinguersi dalle piante esclusivamente alimentari.
L’ipotesi di Johns sulla nascita della medicina grazie alla possibilità di scindere le piante alimentari da quelle medicinali sembra plausibile, ma una divisione assoluta dei due campi, anche materialmente, si avvera solo con l’agricoltura intensiva dell’epoca contemporanea, e coincide con una perdita in qualità dell’alimentazione. Nella estremizzazione dello spettro (piante solo alimentari, solo caloriche, strippate di ogni contenuto allelochimico, e farmaci estremamente attivi, monomolecolari, estremamente potenti) si sono perse (si stanno perdendo) le competenze rispetto a quel mondo ambiguo e variegato nel quale possiamo ingerire alimentandosi sostanze farmacologicamente attive. Ma durante il processo che ci ha portato qui l’uomo ha imparato a distinguere I due campi pur continuando ad utilizzare piante-medicina nell’alimentazione.
Note
[1] Johns T (1990) The Origins of Human Diet and Medicine. University of Arizona Press
[2] Distinzione che però si esplicita solo nell’era moderna, se è vero che per tutta l’antichità classica ed il medioevo i due campi sono ancora molto sovrapposti
[3] Johns 1990 op. cit.
[4] Sarebbe ad esempio scorretto pensare ai cacciatori-raccoglitori come a dei meri sfruttatori del territorio nel quale raccolgono il cibo; anche essi, come gli agricoltori, lo gestiscono, seppure in maniera differente. (Logan M.H., Dixon A.R. “Agricolture and the acquisition of medicinal plants knowledge”. In N.L., Etkin (ed.) (1994) Eating on the wild side: The pharmacologica, ecological, and social implications of using noncultigens pp. 25-45; Moerman D.M. “North american food and drug plants”. In N.L., Etkin (Ed.), 1994 op. cit. pp. 166-184; Diamond, Jared (1997) Guns, Germs, and Steel: the fates of human societies. W.W. Norton & Co. Ed italiana Armi, acciaio e malattie: breve storia del mondo negli ultimi tredicimila anni. Torino, Einaudi 2000). I Siona-Secoya del bacino del Rio delle Amazzoni, ad esempio, derivano il loro cibo principalmente da piante coltivate (in giardini che ricavano nell’intorno della foresta e vicino ai villaggi), da caccia e pesca, ma consumano frequentemente anche i frutti di piante spontanee (in realtà meglio descritte come “antropofite” o invasive) come le palme Ita [Mauritia flexuosa L.f.] e Tucuma [Astrocaryum tucuma C. Martius], il Tacay [Caryodendron orinocense Karsten — Euphorbiaceae], le Inga spp. [Fabaceae], lo Zapote [Quararibea spp. — Bombacaceae], Pseudolmedia laevis [Moraceae], Physalis angulata [Solanaceae] e Phytolacca rivinoides [Phytolaccaceae]. (Vickers WT (1994) “The health significance of wild plants for the Siona and Secoya”. In NL Etkin (1994) pp. 143-165)
[5] Etkin, NL (2006) Edible medicines: An ethnopharmacology of food. Arizona University Press
[6] La separazione tra i due campi non è netta, sono cioè esistiti cacciatori-raccoglitori sedentari, agricoltori non sedentari. E’ probabile che la percentuale di cacciatori-raccoglitori sedentari fosse molto più elevata 15.000 anni fa (quando tutti erano cacciatori-raccoglitori.) che in tempi moderni, perché le risorse erano maggiori
[7] Hanazaki N, Peroni N, Begossi A (2006) “Edible and healing plants in the ethnobotany of native inhabitants of the Amazon and Atlantic forest area of Brazil”. In A. Pieroni, LL Price (eds.) Eating and Healing: Traditional food as medicine. Food Products Press, New York
[8] Pieroni, A. e Quave, C. “Functional foods or food medicines? On the consumption of wild plants among Albanians and Southern Italians in Lucania” in A., Pieroni e L., Leimar Price (eds.) (2006) Eating and Healing, Haworth Press, p. 110
[9] Price LL (2006) “Wild food plants in farming environment”s. In A. Pieroni, LL Price (eds.) Eating and Healing: Traditional food as medicine. Food Products Press, New York.; Johns T (1994) Ambivalence to the palatability factors in wild foods plants. In NL Etkin (ed.) Eating on the wild side: The pharmacological, ecological, and social implications of using noncultigens. Arizona University Press, pp. 46-61e Huss-Ashmore e Johnson 1994 “Wild plants as cultural adaptations to food stres” in NL Etkin (1994) op. cit. pp.
[10] Hanazaki et al. (2006) op. cit.
[11] Si nota quindi che le piante non gestite sono tutte native e coincidono quasi perfettamente con le piante della foresta, mentre le piante coltivate sono per la maggior parte introdotte e si trovano esclusivamente nelle zone ad addebbio
[12] Logan, Dixon, 1994 op. cit.
[13] Turner N.J., (1988) “The importance of a rose: Evaluating the cultural significance of plants” American Anthropology 90:272-290
[14] Grivetti LE (2006) “Edible wild plants as food and as medicine: Reflections on thirty years of field works” in A. Pieroni, LL Price (eds.) Eating and Healing: Traditional food as medicine. Food Products Press, New York
[15] Grivetti LE (2006) “Edible wild plants as food and as medicine: Reflections on thirty years of field works” in A. Pieroni, LL Price (eds.) Eating and Healing: Traditional food as medicine. Food Products Press, New York
[16] L’autore nota anche una perdita di competenze da parte dei giovani a causa di un ridotto trasferimento verticale delle conoscenze tradizionali, un dato riportato da moti altri autori
[17] Grivetti LE (2006) “Edible wild plants as food and as medicine: Reflections on thirty years of field works” in A. Pieroni, LL Price (eds.) (2006) Eating and Healing: Traditional food as medicine. Food Products Press, New York. Questa indagine stimola in Grivetti alcune domande centrali rispetto al ruolo delle piante selvatiche in società in transizione tra caccia-raccolta e agricoltura: le piante selvatiche eduli erano centrali o secondarie rispetto al mantenimento della qualità dell’alimentazione? Esse duplicavano o complementavano l’energia ed i nutrienti derivanti dalle piante coltivate? E’ lo stesso autore a proporre che le competenze sulle piante selvatiche abbiano rappresentato per i baTlokwa una risorsa di duttilità ed adattabilità alimentare che ha aumentato la capacità di rispondere alle emergenze e la variabilità alimentare
[18] Ogle BM e Grivetti LE (1985) “Legacy of the chamaleon. Edible wild plants in the kingdom of Swaziland, southern Africa. A cultural, ecological, nutritional study. Part 1: Introduction, objectives, methods, Swazi culture, landscape, and diet”. Ecology of Food and Nutrition 17:1-30
[19] Etkin NL, e Ross PJ (1994) “Pharmacological implications of “wild” plants in Hausa diet”. In NL Etkin (ed.) 1994 op. cit. ; Humphry C, Clegg MS, Keen C, e Grivetti LE (1993) “Food diversity and drought survival. The Hausa example”. International Journal of Food Sciences and Nutrition 44:1-16
[20] Le piante più comuni sono il baobab [Adansonia digitata L. — Bombaceae], la marula [Sclerocarya birrea (A. Rich.) Hochst. — Anacardiaceae] e il tamarindo [Tamarindus indica L. — Leguminosae]. La raccolta viene effettuata soprattutto (81%) da donne e ragazze per uso familiare, mentre gli uomini raccolgono piante solo per uso personale. cfr. Smith GC, Clegg MS, Keen CL e Grivetti LE (1995) “Mineral values of selected plant foods common to southern Burkina faso and to Niamey, Niger, West Africa”. International Journal of Food Sciences and Nutrition 47:41-43; Smith GC, Duecker SR, Clifford AJ, e Grivetti LE (1996) “Carotenoid values of selected plant foods common to southern Burkina Faso, West Africa”. Ecology of Food and Nutrition 35:43-58
[21] Vainio-Mattila K (2000) “Wild vegetables used by the Sambara in the Usambara Mountains, NE Tanzania”. Annales Botanici Fennici 37:57-67
[22] Dalsin MF, Laca EA, Abuova G, e Grivetti LE (2006) “Livestock-owning households of Kazakstan. Part 1: Food systems”. Ecology of Food and Nutrition 41:301-343
[23] Price LL (2006) op. cit.
[24] Ogle BM e Grivetti LE (1985) op. cit.
[25] Rijal, Arun. (2008) “A Quantitative Assessment of Indigenous Plant Uses Among Two Chepang Communities in the Central Mid-hills of Nepal.” Methods 6: 395-404
[26] Hanazaki, Peroni, Begossi (2006) op. cit.
[27] Dufour DL e Wilson WM (1994) “Characteristics of “wild” plant foods used by indigenous populations in Amazonia”. In NL Etkin (ed.) 1994 op. cit.
[28] Vickers 1994 op. cit.
[29] Volpato G, Godìnez D (2006) “Medicinal foods in Cuba: Promoting health in the household”, in A. Pieroni, LL Price (eds.) Eating and Healing: Traditional food as medicine. Food Products Press, New York
[30] Vandebroek I e Sanca S (2006) Food medicines in the Bolivian Andes (Apillapampa, Cochabamba Department) in A. Pieroni, LL Price (eds.) op. cit.
[31] Secondo l’autrice questa differenza è spiegata dalla teoria del rapporto tra contenuto calorico della pianta ed energia spesa per ottenerla, ma la teoria non tiene conto delle possibili variabili extranutrizionali
[32] L’autrice riporta che tra le piante alimentari e medicinali (che comprendono il 63% di tutte le specie selvatiche) le famiglie botaniche più rappresentate sono le Apiaceae (con 4 specie), le Asteraceae e le Oxalidaceae (2 specie), e le Lamiacese e Caryophylaceae. Lo schema è diverso per le piante eduli: le famiglie più rappresentate sono: Araucariaceae, Berberidaceae, Rosaceae, Celastraceae, Myrtaceae, e Saxifragaceae. cfr. Ladio AH (2006) “Gathering of wild plant foods with medicinal use in a Mapuche community of Northwest Patagonia” in A. Pieroni, LL Price (eds.) op. cit.
[33] Hanazaki, Peroni, Begossi (2006) op. cit.
[34] Harlan JR (1995) The living fields. Our agricoltural heritage. Cambridge, Cambridge University Press
[35] Hanazaki, Peroni, Begossi (2006) op. cit.
[36] Alcorn, J.B. Huastec Maya ethnobotany. University of Texas Press, Austin, Texas, 1984, pp. 311–312.; Arvigo, R., Balick, M. Rainforest Remedies: 100 Healing Herbs of Belize. Lotus Press, Twin Lakes, Wisconsin, 1993; Caniago, I. & Siebert, S.F. (1998) “Medicinal plant ecology, knowledge and conservation in Kalimantan, Indonesia”. Econ. Botany 52:229–250; Frei, B., Sticher, O. & Heinrich, M. (2000) “Zapotec and Mixe use of tropical habitats for securing medicinal plants in Mexico”. Econ. Botany 54:73–81; Posey, D.A. “A preliminary report on diversified management of tropical forest by the Kayapó Indians of the Brazilian Amazon”. In: Prance, G.T., Kallunki, J.A. (Ed.), Ethnobotany in the Neotropics. New York Botanical Garden, New York, 1984, pp. 112–126
[37] Hanazaki, Peroni, Begossi (2006) op. cit.
[38] Stepp J. R., F.S. Wyndham e R.K. Zarger (eds.) Ethnobiology and biocultural diversity. Proceedings of the Seventh International Congress of Ethnobiology, University of Georgia Press, 2002; Moerman, D.E. (2001) “The importance of weeds in ethnopharmacology” Journal of Ethnopharmacology, 1(75): 19-23
[39] Holm L. (1978) “Some characteristics of weed problems in two worlds”. Proc. West. Soc. Weed Sci. 31:3–12
[40] Meilleur BA (1994) “In search of ‘keystone societies’ ”. In NL Etkin (1994) op. cit.
[41] Price LL (2006) op. cit. “A movement away from dependance on plants from forest as food and medicine appears to be accompanied by an increase in comnsumption of plant foods and medicines gathered from the farming environment, and that this occurs as a cross-cultural phenomenon. Thus as agricolture grows and old forest growth declines and is farther and farther away from the dwellings (and gatherers) there is growing reliance on plant foods fron environments disturbed by human activitiy, individual fields, border areas, footh paths etc. Undoubtedly, species composition changes with land use change and agronomic practices. New species are brought into the diet through a process of experimentation, but not without difficulty.”
[42] Conklin H (1961) “The study of shifting cultivation”. Current Anthropology 1:27-61; Kunstader P (1978) “Ecological modification and adaptation: An ethnobotanical view of Lua’swiddeners in northwesterne Thailand”. In R. Ford (Ed.) The nature and status of ethnobotany. Ann Arbor: University of Michigan Museum of Anthropology
[43] Price LL (2006) op. cit.
[44] Stepp (2002) op. cit.; Moerman (2001) op. cit.
[45] Per inciso, questa semplificazione ha in certi casi portato ad un peggioramento dello stato di salute, se è vero che, come indicano i dati sulle popolazioni di cacciatori-raccoglitori ancora esistenti, gli agricoltori lavoravano di più ed erano peggio nutriti, con un minor tasso di sviluppo neonatale, un maggior tasso di malattie (di solito con maggiori infestazioni parassitarie), e minor longevità rispetto ai cacciatori-raccoglitori (probabilmente per un impoverimento della varietà di nutrienti e composti secondari ingeriti). Diamond 1997 op. cit.; Johns 1990 op. cit.; Kiple 1993 op. cit.; Vickers 1994 op. cit.
[46] Logan, Dixon, 1994 op. cit.
[47] Etkin N.L. (Ed.) 1996 op. cit.
[48] Va sottolineato che l’identificazione delle piante come medicinalmente attive da parte delle popolazioni non coincide necessariamente con una loro effettiva efficacia. L’effetto placebo e le influenze culturali sono sempre presenti.








%20%3B%20by%20DAO,%20Aizawl4.jpg)
